
分析 用惰性电极电解饱和的NaCl溶液,阳极上氯离子放电生成氯气,将湿润的淀粉KI试纸放在阳极附近,发现试纸变蓝,说明氯气将碘离子氧化生成碘;待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2又氧化,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据转移电子守恒知,氯气被还原为-1价、碘被氧化为+5价,则两种酸分别是HCl、HIO3,根据反应物和生成物书写方程式.
解答 解:用惰性电极电解饱和的NaCl溶液,阳极上氯离子放电生成氯气,将湿润的淀粉KI试纸放在阳极附近,发现试纸变蓝,说明氯气将碘离子氧化生成碘;待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2又氧化,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据转移电子守恒知,氯气被还原为-1价、碘被氧化为+5价,则两种酸分别是HCl、HIO3,根据反应物和生成物书写方程式为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O═2HIO3+10HCl.
点评 本题以化学方程式的书写为载体考查氧化还原反应,为高频考点,正确判断碘中氧化产物中的化合价是解本题关键,知道氧化还原反应中转移电子守恒,题目难度不大.


科目:高中化学 来源: 题型:解答题
 在容积为2L的密闭容器中,进行反应:A(g)+2B(g)?C(g)+D(g)在不同温度下,D的物质的量n(D)和时间t的关系如图所示.试回答下列问题:
在容积为2L的密闭容器中,进行反应:A(g)+2B(g)?C(g)+D(g)在不同温度下,D的物质的量n(D)和时间t的关系如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温条件下一定能够发生 | |
| C. | 反应物和生成物所具有的总能量的差决定了化学反应是放热还是吸热 | |
| D. | 化学反应才有伴随能量变化,物理变化没有伴随能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Na+、Cu2+、NO3- | B. | Na+、Al3+、OH-、Cl- | ||
| C. | Ag+、K+、Cl-、OH- | D. | Na+、H+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
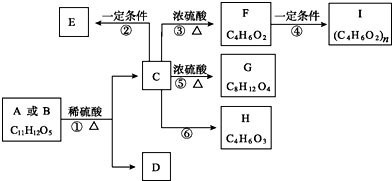
 .
.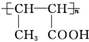 b.D在一定条件下也可以反应形成高聚物
b.D在一定条件下也可以反应形成高聚物 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
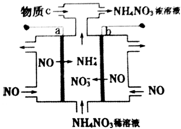
| A. | b为阳极,连接电源的正极 | |
| B. | 阴极反应式为3NO+15e-+18H+═3NH4++3H2O | |
| C. | 为使电解产物全部转化为NH4NO3,需补充的物质c为HNO3 | |
| D. | 总反应式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2NHO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com