
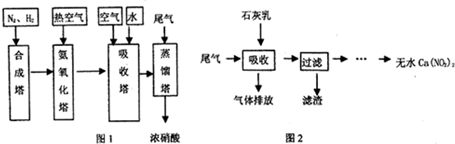
 CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1.
CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1. 6xH2O+(2x+3)N2.
6xH2O+(2x+3)N2. 分析 (1)合成氨中,氮气和氢气在合成塔中反应生成氨气,氮气、氧气都为分子晶体,氮气式量小于氧气,所以分离空气提取氮气的方法为先液化、后汽化或蒸馏,先汽化的气体为氮气,以此提取氮气,水蒸气和甲烷反应生成一氧化碳和氢气,据此书写方程式;根据平衡常数用三段式法计算;
(2)合成氨的反应属于放热反应,热交换器可以充分利用余热,节约能源;在吸收塔中二氧化氮与水反应生成硝酸和NO,NO能被氧气氧化为二氧化氮;
(3)使尾气中NO、NO2与石灰乳充分接触;滤渣的主要成分是Ca(OH)2;若<1:1,则二氧化氮过量;
(4)NH3能使NOx转化为N2和水,根据化学方程式的书写知识来回答.
解答 解:(1)工业合成氨的原料是N2和H2,反应原料N2可从空气中分离出来,方法是先将空气液化,然后蒸馏或控制N2的沸点加热蒸发,氮气先汽化,即可得到,水蒸气和甲烷反应生成一氧化碳和氢气,反应为:CH4+H2O(g)  CO+3H2,
CO+3H2,
设CO的起始浓度为xmol,H2O的起始浓度为ymol,则转化的CO的最小值为0.8x,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始 x y 0 0
变化 0.8x 0.8x 0.8x 0.8x
平衡 0.2x y-0.8x 0.8x 0.8x,
根据平衡常数列式:$\frac{(0.8x)^{2}}{0.2x×(y-0.8x)}$=0.64,
解得:$\frac{y}{x}$=5.8:1.故此只要此值大于5.8,转化率就会超过80%.
故答案为:分离液态空气法;CH4+H2O(g)  CO+3H2; 5.8:1;
CO+3H2; 5.8:1;
(2)合成氨的反应属于放热反应,反应过程中会放出大量的热,用热交换器可以充分利用余热,节约能源;在吸收塔中二氧化氮与水反应生成硝酸和NO,通入空气,NO能被空气中的氧气氧化为二氧化氮,二氧化氮再与水反应生成硝酸,这样使NO循环利用,全部转化为硝酸;
故答案为:充分利用余热,节约能源;可使NO循环利用,全部转化成HNO3;
(3)使尾气中NO、NO2与石灰乳充分接触,NO、NO2被充分吸收;滤渣主要成分是Ca(OH)2,若n(NO):n(NO2)<1:1,则二氧化氮过量,二氧化氮可与石灰乳反应生成Ca(NO3)2,
故答案为:使尾气中NO、NO2被充分吸收;Ca(OH)2;产品Ca(NO2)2中Ca(NO3)2含量升高;
(4)NH3能使NOx转化为N2和水,化学方程式为4xNH3+6NOx 6xH2O+(2x+3)N2,
6xH2O+(2x+3)N2,
故答案为:4xNH3+6NOx 6xH2O+(2x+3)N2.
6xH2O+(2x+3)N2.
点评 本题考查学生在“工艺流程阅读分析,化学反应原理在工艺流程的应用,氧化还原反应分析,相关反应的书写”等方面对元素化合物性质及其转化关系的理解和应用程度,考查学生对新信息的处理能力,掌握合成氨的原理以及利用三段式法计算平衡问题是解答关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 液溴受热变成溴蒸气 | B. | 加热金刚石使之熔化 | ||
| C. | 加热食盐使之熔化 | D. | 加热碘化氢使之分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化碳是一种宝贵的碳氧资源.以C02和NH3
二氧化碳是一种宝贵的碳氧资源.以C02和NH3查看答案和解析>>
科目:高中化学 来源: 题型:多选题
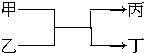 若甲、丙均为短周期,不同主族元素组成的单质,乙、丁都是氧化物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙均为短周期,不同主族元素组成的单质,乙、丁都是氧化物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )| A. | 碳和镁 | B. | 氟气和氧气 | C. | 碳和氢气 | D. | 氧气和硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤③ | B. | ⑥①⑤③ | C. | ⑧①⑦③ | D. | ⑤②⑥③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
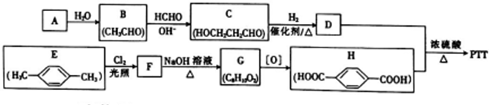
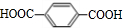 +n HOCH2CH2CH2OH$→_{△}^{浓硫酸}$
+n HOCH2CH2CH2OH$→_{△}^{浓硫酸}$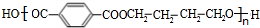 +(2n-1)H2O,该反应的反应类型为缩聚反应.
+(2n-1)H2O,该反应的反应类型为缩聚反应.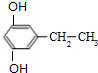 (填结构简式,任写一种)
(填结构简式,任写一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:6 | |
| B. | HCl发生还原反应 | |
| C. | 氧化性KClO3>Cl2 | |
| D. | 被还原的物质是HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com