
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)=CO2(g) ΔH1 C(s)+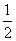 O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2(g)=SO2(g) ΔH3 S(g)+O2(g)=SO2(g) ΔH4
③H2(g)+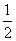 O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
A.① B.④ C.①②③ D.②③④
科目:高中化学 来源: 题型:
甲是一种盐,由A、B、C、D、E五种元素组成,其中四种是短周期元素。甲溶于水后可电离出由上述元素组成的三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。
用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中加入适量NaOH溶液,加热;
③取少量甲溶液于试管中滴入KSCN溶液,无现象,再滴入氯水,溶液呈红色;
④取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
回答下列问题:
(1)C在周期表中的位置 。
(2)实验②中出现的现象是 。
(3)用离子方程式表示实验③中现象的原因: ;若向此时溶液中加入KCl溶液,此溶液中的平衡(非水的电离平衡及盐的水解平衡)将 (填 “不移”,“左移”,“右移”)。
(4)由A、B、D、E组成的阳阴粒子个数比为1:2的盐X,在X的水溶液中,c(H+)==________________。
(5)经测定甲晶体的摩尔质量为392 g/mol,其中阳离子与阴离子物质的量之比为3:2,则甲晶体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中物质的量浓度为1 mol·L-1的是( )。
A.将40 g NaOH固体溶解于1L水中
B.将22.4 L氯化氢气体溶于水配成1L溶液
C.将1L 10 mol·L-1的浓盐酸与9 L水混合
D.10 g NaOH固体溶解在水中配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
6 g Na2X含Na+的物质的量为0.4 mol,则Na2X的摩尔质量为________,X的相对原子质量为________,若将上述样品溶解于水中配成200 mL的溶液,则所得溶液的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
①电解池是将化学能转变成电能的装置 ②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化。
A.①②③④ B.③④ C.③④⑤ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池 ,①②相连时,外电路电流从②流向① ;①③相连时,③为正极;②④相连时,②有气泡逸出 ;③ ④ 相连时,③ 的质量减少 ,据此判断这四种金属活动性由大到小的顺序是( )
A . ①③②④ B . ①③④②
C. ③ ④ ②① D . ③ ① ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.标准状况下,11.2 L NH3溶于1 L水,溶液中含有N原子的微粒总数为0.6NA
B.1.00 mol NaCl中,所有Na+的最外层电子总数约为8×6.02×1023
C.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
D.1mol FeCl3完全转化为Fe(OH)3胶体后形成NA个胶粒.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是 ( )
A.锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快产生气泡的速率
B.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
C.电镀时,应把镀件置于电解槽的阴极
D.钢铁表面常易锈蚀生成Fe2O3·nH2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com