
| A. | 二氧化硅能与水反应 | |
| B. | 用二氧化硅制取单质硅,当生成2.24 L(标准状况下)气体时,得到2.8g硅 | |
| C. | 二氧化硅属于传统的无机非金属材料 | |
| D. | 二氧化硅不能与碳酸钠溶液发生反应,但在高温下能与碳酸钠固体发生反应 |
分析 A.二氧化硅不溶于水;
B.根据反应的化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑来计算;
C.传统无机非金属材料:陶瓷、玻璃、水泥(全是硅酸盐);
D.硅酸酸性弱于碳酸,高温下二氧化硅与碳酸钠反应生成硅酸钠和二氧化碳.
解答 解:A.二氧化硅不溶于水,与水不反应,故A错误;
B.由方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,可得当生成2.24 L即0.1mol气体时,得到0.05mol即1.4g硅,故B错误;
C.二氧化硅不是传统无机非金属材料,故C错误;
D.硅酸酸性弱于碳酸,高温下二氧化硅与碳酸钠反应生成硅酸钠和二氧化碳,故D正确;
故选:D.
点评 本题考查了硅及其化合物,熟悉相关物质的性质及用途是解题关键,题目难度不大,注意传统无机非金属材料概念.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:解答题
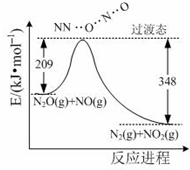 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 碳酸氢钙与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 用稀硝酸除去试管内壁银:Ag+2H++NO3-═Ag++NO2↑+H2O | |
| D. | 向氨水中通入过量SO2:SO2+2NH3•H2O═2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
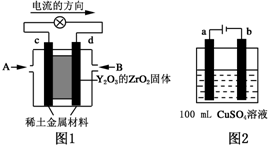 (1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e--→2O2-).
(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e--→2O2-).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
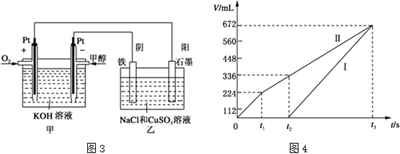
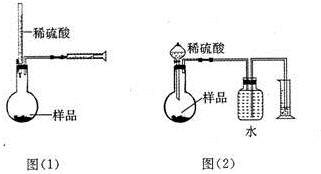 为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.
为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PCl3的水解产物是PH3和HCl | B. | CuCl2的水解产物是Cu(OH)2和HCl | ||
| C. | NaClO的水解产物是HClO和NaOH | D. | CaO2的水解产物是Ca(OH)2和H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢与氢氧化钠反应的中和热△H=-57.3kJ/mol,则硫酸和氢氧化钡反应的△H=-2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0KJ/mol,则表示一氧化碳的燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知: Ⅰ:对于反应:H2(g)+Cl2(g)=2HCl(g)△H=-a kJ/mol Ⅱ:  且a、b、c均大于零,则断开1摩尔H-Cl键所需的能量为(-a-b-c) kJ/mol 且a、b、c均大于零,则断开1摩尔H-Cl键所需的能量为(-a-b-c) kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )| A. | 若X为KOH溶液,则A可能为Al | |
| B. | 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2 | |
| C. | 若X为O2,则A可为非金属单质硫 | |
| D. | 若X为Fe,则C可能为Fe(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水石蕊溶液 | B. | 氢氧化钠溶液和溴水 | ||
| C. | 溴水和高锰酸钾酸性溶液 | D. | 高锰酸钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com