



 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| A、C5H12 |
| B、C4H10 |
| C、C3H8 |
| D、C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液加入试管中,加入过量的2mol?L-1盐酸,再滴加适量1mol?L-1 BaCl2溶液. | 有白色沉淀生成,证明待测溶液中含SO42- |
| 步骤② | ||
| 步骤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
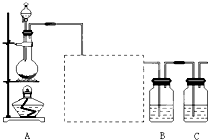
查看答案和解析>>
科目:高中化学 来源: 题型:
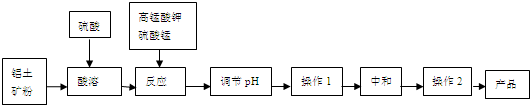
| n(MnO2) |
| n(Fe) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2=Ca2++2Cl- |
| B、Ba(OH)2=Ba2++2OH- |
| C、HNO3=H++NO3- |
| D、NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
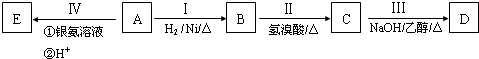
 ,由单体F制有机玻璃的反应类型是
,由单体F制有机玻璃的反应类型是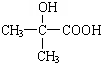 ,写出由G作为单体在一定条件下生成聚酯的化学方程式:
,写出由G作为单体在一定条件下生成聚酯的化学方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com