
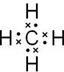
 ,故答案为:
,故答案为: ;
;
| ||
| 熔融、冰晶石 |
| ||
| 熔融、冰晶石 |
 ,故答案为:
,故答案为: ;
;
| ||
| ||


 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
 在如图中,E和F分别为电源两极;甲烧杯中盛有100mL 0.2mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.15mol?L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则
在如图中,E和F分别为电源两极;甲烧杯中盛有100mL 0.2mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.15mol?L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则查看答案和解析>>
科目:高中化学 来源: 题型:
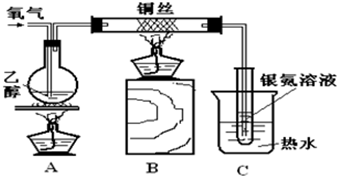

查看答案和解析>>
科目:高中化学 来源: 题型:
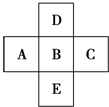 如图所示,已知A元素的最低化合价为-3价,D元素和B元素可形成2种化合物.试回答下列问题(均用具体的元素符号回答):
如图所示,已知A元素的最低化合价为-3价,D元素和B元素可形成2种化合物.试回答下列问题(均用具体的元素符号回答):查看答案和解析>>
科目:高中化学 来源: 题型:
元素 | 各电子层的电子数 | ||||
| K | L | M | N | ||
| A | 2 | 7 | |||
| B | 2 | 8 | 1 | ||
| C | 2 | 8 | 18 | 7 | |
| D | 2 | 8 | 2 | ||
| E | 2 | 8 | 7 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
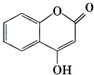 可用来制备抗凝血药,通过如图路线合成:
可用来制备抗凝血药,通过如图路线合成:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com