
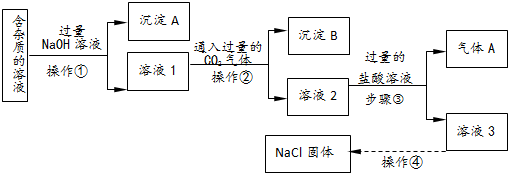
分析 由实验流程可知,含有少量AlCl3、MgCl2、CuCl2杂质的NaCl溶液,加入过量的NaOH,生成沉淀A为Mg(OH)2、Cu(OH)2,和溶液1为NaAlO2、NaCl、NaOH的混合溶液,通入过量的二氧化碳,得到沉淀B为Al(OH)3,溶液2为NaCl、NaHCO3的混合溶液,再在混合溶液中加入盐酸生成气体A为,溶液3为NaCl、HCl的混合溶液,再经过蒸发结晶可得氯化钠固体,以此解答该题.
解答 解:由实验流程可知,含有少量AlCl3、MgCl2、CuCl2杂质的NaCl溶液,加入过量的NaOH,生成沉淀A为Mg(OH)2、Cu(OH)2,和溶液1为NaAlO2、NaCl、NaOH的混合溶液,通入过量的二氧化碳,得到沉淀B为Al(OH)3,溶液2为NaCl、NaHCO3的混合溶液,再在混合溶液中加入盐酸生成气体A为,溶液3为NaCl、HCl的混合溶液,再经过蒸发结晶可得氯化钠固体,
(1)由以上分析可知,沉淀A的主要成分是Mg(OH)2、Cu(OH)2,
故答案为:Mg(OH)2、Cu(OH)2;
(2)操作①?因故分离固体和液体,为过滤操作,故答案为:过滤;
(3)①反应剩余的NaOH和过量的CO2发生反应的化学方程式为NaOH+CO2=NaHCO3,故答案为:NaOH+CO2═NaHCO3;
(4)步骤③为碳酸氢钠与盐酸的反应,反应的离子方程式是HCO3-+H+═H2O+CO2↑,故答案为:HCO3-+H+═H2O+CO2↑;
(5)操作④由溶液得到晶体,为蒸发操作,用到的仪器有玻璃棒、火柴、酒精灯、带铁圈的铁架台和蒸发皿,
故答案为:蒸发; 蒸发皿.
点评 本题考查物质的分离提纯操作方法,为高频考点,侧重于学生的分析、实验能力的考查,题目难度中等,解答时注意明确Cl-、SO42-的性质,把握除杂原则,提纯时不能引入新的杂质,注意把握实验的先后顺序.


科目:高中化学 来源: 题型:选择题
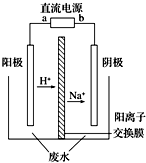 最近有研究人员发现了一种处理高浓度乙醛废水的新方法--隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法--隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 电解过程中,阴极区消耗Na+ | |
| B. | 阳极反应为CH3CHO-2e-+2H+═CH3COOH+H2O | |
| C. | 电解的总反应方程式为2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3COOH+CH3CH2OH | |
| D. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下水溶液的pH:Na2CO3>Na2SO4 | |
| B. | 酸性:H2SO3>H2CO3 | |
| C. | CH4比NH3更稳定 | |
| D. | C与H2的化合价比N2与H2的化合更容易 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
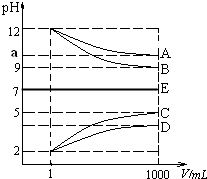 物质A~E都是由NH4+、H+、Na+、OH-、CH3COO-、Cl-中离子两两组成(离子可重复,如NaCl、HCl).常温下将各物质的溶液从1mL稀释到1000mL,pH的变化如甲图所示.请回答:
物质A~E都是由NH4+、H+、Na+、OH-、CH3COO-、Cl-中离子两两组成(离子可重复,如NaCl、HCl).常温下将各物质的溶液从1mL稀释到1000mL,pH的变化如甲图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=8.3 的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
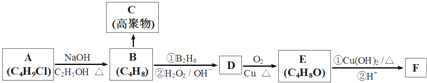
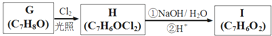
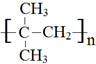 ,
,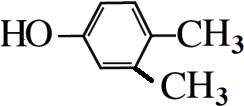 .
.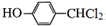 +3NaOH$→_{△}^{水}$
+3NaOH$→_{△}^{水}$ +2NaCl+2H2O.
+2NaCl+2H2O.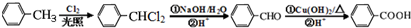 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和酸反应,放出标准状况下的22.4L气体,转移的电子数必为2NA | |
| B. | 将标准状况下,11.2LN2和33.6LH2混合,在一定条件下充分反应,产生的NH3的分子数为2NA | |
| C. | 常温常压下,6g乙酸所含共价键数目为0.7NA | |
| D. | 1L 0.1mol•L-1碳酸钠溶液中,阴离子数目大于0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com