
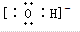 ;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.
;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.分析 由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子.已知A、E是由非金属元素组成的阳离子,
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝,则C是氨气;
①A、B两种离子在加热条件下可生成C、D两种分子,A是10电子的阳离子,能生成氨气,则A是铵根离子,B是氢氧根离子,D是水;
③1molB离子与1molE离子作用可生成2mol D分子,则E是水合氢离子;
④向含F离子的溶液中加入氨气的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解则F是铝离子,沉淀W是氢氧化铝;
(1)通过以上分析知,B为氢氧根离子,氢氧根离子为阴离子,需要标出所带电荷及最外层电子;E是水合氢离子,F是铝离子,在周期表中位于第三周期第IIIA族;
(2)铝离子和氨水反应生成氢氧化铝和铵根离子;氢氧化铝和氢氧根离子反应生成偏铝酸根离子和水;
(3)a.溶液中出现白色沉淀,c.沉淀逐渐增多,e.沉淀逐渐减少,d.沉淀完全消失,说明此沉淀为Al(OH)3,则该复盐中含有Al3+,b.有刺激性气味气体放出,说明该复盐中含有NH4+,则该复盐为NH4Al(SO4)2,NH4Al(SO4)2在溶液中完全电离出铵根离子、铝离子和硫酸根离子.
解答 解:由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子.已知A、E是由非金属元素组成的阳离子,
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝,则C是氨气;
①A、B两种离子在加热条件下可生成C、D两种分子,A是10电子的阳离子,能生成氨气,则A是铵根离子,B是氢氧根离子,D是水;
③1molB离子与1molE离子作用可生成2mol D分子,则E是水合氢离子;
④向含F离子的溶液中加入氨气的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解则F是铝离子,沉淀W是氢氧化铝;
(1)通过以上分析知,B为氢氧根离子,氢氧根离子为阴离子,其电子式为: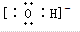 ;E是水合氢离子,F是铝离子,在周期表中位于第三周期第IIIA族,
;E是水合氢离子,F是铝离子,在周期表中位于第三周期第IIIA族,
故答案为: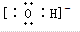 ;水合氢离子;第三周期、ⅢA族;
;水合氢离子;第三周期、ⅢA族;
(2)铝离子和氨水反应生成氢氧化铝和铵根离子,离子反应方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
氢氧化铝和氢氧根离子反应生成偏铝酸根离子和水,离子反应方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;Al(OH)3+OH-═AlO2-+2H2O;
(3)a.溶液中出现白色沉淀,c.沉淀逐渐增多,e.沉淀逐渐减少,d.沉淀完全消失,说明此沉淀为Al(OH)3,则该复盐中含有Al3+,b.有刺激性气味气体放出,说明该复盐中含有NH4+,则该复盐为:NH4Al(SO4)2,NH4Al(SO4)2在溶液中的电离方程式是:NH4Al(SO4)2═Al3++NH4++2SO42-,
故答案为:NH4Al(SO4)2;NH4Al(SO4)2═Al3++NH4++2SO42-.
点评 本题考查原子结构与性质的综合应用,题目难度中等,明确10电子原子或分子、离子有哪些是解本题关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电解水:2H20=2H2↑+O2↑ | B. | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||
| C. | 2F2+H2O=4HF+O2 | D. | 3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
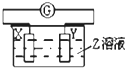 如图所示装置,电流表G发生偏转,同时X极逐渐变粗,Y极逐渐变细,Z是电解质溶液,则X、Y、Z应是下列各组中的( )
如图所示装置,电流表G发生偏转,同时X极逐渐变粗,Y极逐渐变细,Z是电解质溶液,则X、Y、Z应是下列各组中的( )| A. | X是Zn,Y是Cu,Z为稀H2SO4 | B. | X是Cu,Y是Zn,Z为稀H2SO4 | ||
| C. | X是Fe,Y是Ag,Z为稀AgNO3溶液 | D. | X是Ag,Y是Fe,Z为稀AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取氢气时,改用浓硫酸 | |
| C. | 将锌与稀硫酸反应时,向溶液中加入少量CuSO4 晶体 | |
| D. | 用碳还原Fe2O3冶炼铁时,增大碳的用量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com