
 (1)我国西周年代写成的算卦占卜的书《周易》中,在谈到一些自然界发生的现象时说:“象曰:‘泽中有火’”试用化学方程式表示出泽中有火的化学反应CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O.西气东输是我国油气管道建设史上距离最长的输气管道,总长3900公里,设计年输气量120亿立方米.这里说的气就是天然气,天然气的主要成分是甲烷(填名称),试分析使用天然气的优点清洁无污染.
(1)我国西周年代写成的算卦占卜的书《周易》中,在谈到一些自然界发生的现象时说:“象曰:‘泽中有火’”试用化学方程式表示出泽中有火的化学反应CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O.西气东输是我国油气管道建设史上距离最长的输气管道,总长3900公里,设计年输气量120亿立方米.这里说的气就是天然气,天然气的主要成分是甲烷(填名称),试分析使用天然气的优点清洁无污染.分析 (1)“泽中有火”的原因是沼泽地能产生沼气;天然气的主要成分为甲烷;甲烷燃烧无污染;
(2)根据已知的反应方程式,来分析相同体积的液化石油气、天然气消耗的氧气的多少,消耗氧气多时需要增大空气的进入量,消耗氧气少的则应减小空气的进入量;
(3)如果甲烷中含有H元素,则会燃烧生成水;如果甲烷中含有碳元素,则会燃烧生成二氧化碳;通过产物,只能说明甲烷中是否含有C、H元素,不能说明O元素的是否存在,故应根据甲烷的质量和其中含有的C、H元素质量和之间的大小关系来确认有无氧元素的存在.
解答 解:(1)“泽中有火”的原因是沼泽地能产生沼气,而沼气的主要成分为甲烷,燃烧的化学方程式为:CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O;天然气的主要成分为甲烷;甲烷燃烧生成二氧化碳和水,环保无污染,故答案为:CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O;甲烷;清洁无污染;
(2)由天然气的主要成分为CH4,液化石油气的主要成分为C3H8,燃烧的化学方程式为CH4+2O2→CO2+2H2O;C3H8+5O2→3CO2+4H2O.显然相同体积的C3H8、CH4,C3H8消耗的氧气多,如果用户从天然气改为液化石油气,应需要增大空气的进入量,故答案为:增大;
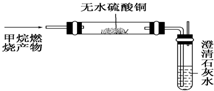
(3)如果甲烷中含有H元素,则会燃烧生成水,从而能使无水硫酸铜变蓝色;如果甲烷中含有碳元素,则会燃烧生成二氧化碳,从而能使澄清石灰水变浑浊;通过产物,只能说明甲烷中是否含有C、H元素,但不能说明O元素的是否存在,故应根据甲烷的质量和其中含有的C、H元素质量和之间的大小关系来确认有无氧元素的存在,故所需的数据为①②③.
故答案为:无水硫酸铜变蓝色;澄清石灰水中变浑浊;不能;氧;①②③.
点评 本题考查了天然气、沼气的主要成分甲烷的有关性质和元素的检验,难度不大,应注意的是根据甲烷的燃烧产物只能定性分析出甲烷中含碳和氢元素,不能确认氧元素的存在,必须经过定量计算.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 完全氧化56gFe需要消耗氯气33.6 L | |
| B. | 某浓度氢氧化钠溶液恰好溶解5.4g的铝,则被还原的水的分子数为0.6NA | |
| C. | 向100mL 1mol/L的NaHSO3溶液中加入足量的硫酸铁,则反应后氢离子增加0.4mol | |
| D. | 利用铝热反应将磁铁矿还原得到16.8g铁单质,反应中Fe得到了0.9 NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该温度高于25℃ | |
| B. | 由水电离出来的H+的浓度是1.0×10-12 mol•L-1 | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | c(H+)=c(OH-)+c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
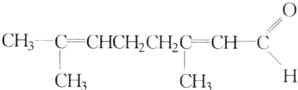 根据已有知识判定下列说法中不正确的是( )
根据已有知识判定下列说法中不正确的是( )| A. | 可使酸性高锰酸钾溶液褪色 | B. | 可跟银氨溶液反应生成银镜 | ||
| C. | 可使溴水褪色 | D. | 催化加氢后最终产物是C10H20O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA | |
| B. | 1mo1的Fe在1mo1Cl2中充分燃烧,转移电子数为3NA | |
| C. | 7.2g CaO2中的阴离子含有的电子数为1.0NA | |
| D. | 标准状况下,22.4L盐酸含有2NA个离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com