
| A. | 标准状况下,2.24 L C12与足量铁粉反应转移的电子数为0.2NA | |
| B. | 2 L 0.1 mol•L-1Na2CO3溶液中所含CO32-的数目为0.2NA | |
| C. | 28 g C2H4所含共用电子对数目为4NA | |
| D. | 1 mol H2O中所含的中子数为10NA |
分析 A、标准状况下,2.24 L C12的物质的量为0.1mol,与足量的铁反应生成氯化铁,氯元素由0价变成-1价;
B、碳酸钠是强碱弱酸盐,碳酸根离子水解;
C、28 g C2H4的物质的量为:1mol,而1mol C2H4含6mol共用电子对;
D、一个 H2O分子含有8个中子;
解答 解:A、标准状况下,2.24 L C12的物质的量为0.1mol,与足量的铁反应生成氯化铁,氯元素由0价变成-1价,所以0.1mol的氯气转移电子数为0.2NA,故A正确;
B、碳酸钠是强碱弱酸盐,碳酸根离子水解,所以2 L 0.1 mol•L-1Na2CO3溶液溶质的物质的量为0.2mol,所含CO32-的数目小于0.2NA,故B错误;
C、28 g C2H4的物质的量为:1mol,而1mol C2H4含6mol共用电子对,所以28 g C2H4所含共用电子对数目为6NA,故C错误;
D、一个 H2O分子含有8个中子,所以1 mol H2O中所含的中子数为8NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数,涉及化学反应中电子的转移、中子数的计算,明确有机物的结构和分子所含中子数、电子数、转移电子数是解题的关键.


科目:高中化学 来源: 题型:选择题
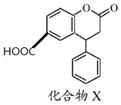
| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和NaHCO3溶液反应 | |
| C. | 化合物X可以由 和 和 通过酯化反应得到 通过酯化反应得到 | |
| D. | 1 mol化合物X最多能与3 molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOC3H7 | B. | CH3COOC2H5 | C. | CH3COONa | D. | CH3CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32gO2和O3的混合物中,所含氧原子数为2NA | |
| B. | 标准状况下,22.4LCl2与水反应,转移电子数为2NA | |
| C. | 标准状况下,3.36L辛烷中,所含碳原子数为1.5NA | |
| D. | 含1molFeCl3的饱和溶液,逐滴加入沸水中,完全形成Fe(OH)3胶体,胶粒数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯硫酸的摩尔质量为98 | |
| B. | 上述100mL稀硫酸中含溶质14g | |
| C. | 上述稀释过程所需要的蒸馏水为90mL | |
| D. | 质量分数为50%的硫酸物质的量浓度为7.14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na2S除去废水中的Hg2+ | B. | 用热的Na2CO3溶液去油污 | ||
| C. | 利用油脂的皂化反应制造肥皂 | D. | 配制CuSO4溶液时加少量稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
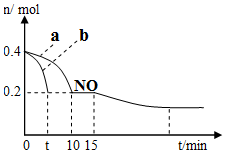 研究发现,NOx和SO2是雾霾的主要成分,已知:
研究发现,NOx和SO2是雾霾的主要成分,已知:| 化学式 | H2CO3 | H2SO3 |
| 电离平衡常数 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com