
������16�֣���ҵ���ð���ʯ�Ʊ��ߴ�����þ�Ĺ����������£�
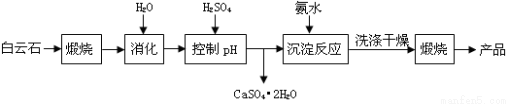
��֪��.����ʯ��Ҫ�ɷֿɱ�ʾΪ��CaO 32.50%��MgO 20.58%��Fe2O3 2.18%��SiO2 0.96%������ 43.78%��
��1��Ϊ����߰���ʯ������Ч�������Բ�ȡ�Ĵ�ʩ�ǽ���ʯ ������ʵ���������հ���ʯ����Ҫ���������ƾ��ơ����ż����⣬����Ҫ ������ţ���
A�������� B������ C�������� D��ʯ����
��2������H2SO4����pHʱ���յ�pH�Բ�Ʒ��Ӱ����ͼ8��ʾ������ͼʾ�ɵõ��Ľ��ۼ�ԭ���ǣ�

��pH���ᵼ��___________________________�½�����ԭ����_______________________
��pH���ͻ�����____________________________ ����ԭ�������__________(�����)
A.Fe2O3����H2SO4����ʹ��Ʒ�������� B.SiO2����H2SO4����ʹ��Ʒ��������
C.���Թ�ǿ���γɿ��ܵ�Ca(HSO4)2������ʹ��Ʒ���к��Ƶ�����
��3����֪MgSO4��CaSO4���ܽ�����±���
�¶ȣ��棩 | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
�����ϱ����ݣ���Ҫ˵������CaSO4.2H2O�IJ��������� �� ��
��4��д��������Ӧ�е����ӷ���ʽ�� ��
��5�������������л��ɵõ���һ�ָ���Ʒ��_______________��
��6����֪���ָʾ�����������ɫ��pH��Χ�����ʾ��25��ʱ��
��Mg(OH)2�ı�����Һ�еμ�2�ΰ������ָʾ������Һ�����ֵ�
��ɫΪ ��25��ʱ��Mg(OH)2���ܶȻ�Ksp=5.6��10-12����
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
��ɫ | ��ɫ | ��ɫ | ��ɫ |
32. �𰸣�16�֣�
��1������ ��2�֣�BC ��2�֣�
��2����þ�����ʽ��ͣ�1�֣�Mg(OH)2��MgOδ��ȫ�ܽ⣨1�֣�
�ڲ�Ʒ�����½���1�֣�AC ��1�֣�
��3�����½ᾧ�����ȹ��� ��2�֣���1�֣���
��4��Mg2+ +2NH3.H2O = Mg(OH)2��+ 2NH4+ ��2�֣�
��5��(NH4)2SO4 ��2�֣�
��6����ɫ ��2�֣�
��������
��������� ��1����߿�ʯ����Ч���Ĵ�ʩͨ���ǶԿ�ʯ���з��鴦����������Ӧ�ĽӴ�������Ӷ��ӿ췴Ӧ���ʣ�ʹ���ո��ӳ�֡�����ʵ�������հ���ʯ��������Ҫ������װ���оƾ��ơ����żܡ��������������ᡢ��ǯ�ȣ����Դ˴�����ѡBC��
��2����ͼ�������������ߣ�������ʾ�����ϴ�ڵ����þ���������ߣ����������ź������յ�pH�������ֳ����½������ƣ��ҵ�pH>6ʱ���������½���Խ��Խ�죻�������ϴ�С�����������þ�Ĵ��ȣ��ô������ź������յ�pH��������ֳ���������ƣ����ǽϲ�ͬ���ǣ���ʼ����Ѹ�٣���pH>6ʱ������þ�Ĵ����������ԡ����Ԣ�pH���ᵼ��þ�Ľ����ʽ��ͣ�ԭ���Ǽ������ܽ�ʱ����pH���ߣ��������MgO������ȫ�ܽ⡣
��pH���ͻ������Ƶõ�����þ�Ĵ���ƫ�ͣ�ԭ���ǰ���ʯ�е�����������Fe2O3 ��CaO�����������ᣬ�������ɿ��ܵ����ʣ�����AC���п��ܣ�ѡAC��
��3���ɱ������ݿ�֪������þ������ˮ���ܽ�����¶����߶����ߣ��������������ˮ�������¶������ܽ�Ȼ������䣬�������ö����ܽ���ϵIJ��죬��Ҫ��������ƾ����������Բ�ȡ�Ĵ�ʩ�����½ᾧ�����ȹ��ˡ�
��4�����������з�Ӧ���е���ҪΪþ���ӣ����Լ��백ˮ����ˮ��þ���ӽ�����ɳ���������þ���������ӷ���ʽ��Mg2+ +2NH3.H2O = Mg(OH)2��+ 2NH4+ ��ע�ⰱˮ���ܲ�
��5����������������Mg(OH)2 ����Һ��ʣ��NH4+ ��SO4 2-�����Կ������ô�ʣ����Һ�Ƶø���Ʒ(NH4)2SO4 �������������ʡ�
��6�����͵�������þ��Һ����Mg(OH)2 ��s��= Mg2+��aq�� + 2 OH-��aq���ܽ�ƽ�⣬2c��Mg2+��= c��OH -�������ܶȻ�Ksp= c��Mg2+��c2��OH -��=5.6��10-12 ���ɴ˿��Եó�c��OH -��=3.6��10-4 ������pH>9.6�����Լ���������ָʾ������Һ����ɫ��
���㣺���⿼����ǻ�ѧ�������̡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ������һ����У�����5����ģ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ȷ����
A���ں����������п�鱣����Dz��ܸ�ʴ�Dz�������������������������
B����ͼ�е�����Zn������Cu�������е�Cl������CuSO4��Һ
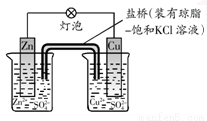
C������ȼ�ϵ��(���Ե����)��O2ͨ���������缫��ӦΪO2��4H+ ��4e����2H2O
D�����ʱ��ͨ���Ѵ��ƵĽ�����Ʒ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ��һѧ�����տ��Ը�һ����ѧ���Ծ����������棩 ���ͣ������
��KBr��KI�Ļ��Һ��ͨ�������Cl2������ˮ�����⣬��Һ����Ҫ�� ______���ӣ�������Һ���ɵõ��������պ�ʣ�� ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ��һѧ�����տ��Ը�һ����ѧ���Ծ��ң������棩 ���ͣ�������
�����ձ��м�����ͬ�����1��5mol/L��ϡ���ᣬ������ƽ�������������ϣ�������ƽ��ʹ֮�ﵽƽ�⣬��һ���ձ��м���5��4gþ����һ���ձ��м���5��4g�����Ը��ݼ�����з�����������ȡ��ͬ���ʱ����Ӧ��Ϻ���ƽ���ܻᷢ���ı仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ��һѧ�����տ��Ը�һ����ѧ���Ծ��ң������棩 ���ͣ�ѡ����
a��CO��O2�Ļ�����壬��ȼ��õ�b�����壨ǰ��������ͬ��������������CO�������������������е� �� ��
��b ��2a/3 ��a��b ��a��b ��2(a��b)
A���٢ڢ� B���ڢܢ� C���٢ڢ� D���٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ�����и�����У4���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
25�棬pH=3�Ĵ�����Һ��I����pH=ll������������Һ��II��������˵����ȷ����( )
A��I��II��H2O�ĵ���̶Ȳ����
B����Iϡ��l0������Һ��c��CH3COOH����c��OH��������С
C��I��II��Һ��ϣ���c��OH������c��H+��������������һ������
D��I��II�������Ϻ���Һ������Ũ�ȴ�СΪc��CH3COO����+ c(CH3COOH��c��Na+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ�����и߿�Ԥ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
������16�֣���ˮAlCl3�������л��ϳɵĴ�����ʳƷ���ɼ��ȡ���ҵ�Ʊ���ˮAlCl3���������£�

��1���Ȼ�¯��ͨ��O2��Ŀ���� _________��
��2���Ȼ�¯��Al2O3��C12��C��Ӧ�Ļ�ѧ����ʽ��____________________________��
��3���Ȼ�¯�е��������壬ͨ��������������Һ�����գ���д����Na2SO3��Һ����β��ʱ������Ӧ�����ӷ���ʽ___________________________________________________��
��4�����������м������۵�Ŀ����_________________________________________��
��5�����Ȼ������壨AlCl3��6H2O����HCl���м���Ҳ�ܽ�����ˮ�Ȼ������Ʊ�������ʵ���������Ʋ��������յõ��������Ǽ�ʽ�Ȼ���[��ѧʽΪAl2(OH)nCl(6-n)]����������ԭ�Ȼ������壨AlCl3��6H2O����40%���������n��ֵΪ ��
��6�����������У�������Ϊ�����������ε��Һ����Ԫ����Ҫ��AlCl4����ʽ���ڣ��������ĵ缫��ӦʽΪ___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ�߿�Ԥ�����ۻ�ѧ�Ծ����������棩 ���ͣ�ѡ����
��55��ʱ������˵����ȷ����
A����ˮ�м��������������ƹ��壬�ٽ���ˮ�ĵ��룬c(H+)����Kw����
B��pH=8��NaHCO3��Һ�У�c(OH-)=1��10-6mol/L
C��������ˮ�У�c(Cl2)=2c(ClO��)+2c(Cl��)+2c(HClO)
D��0.1mol/L��(NH4)2SO4��Һ�У�c(NH4+) > c(SO42-) > c(H+) > c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ�����и���4�µڶ���ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ�������ȷ���ܴﵽԤ��Ŀ�ĵ���
| ʵ��Ŀ�� | ���� |
A | �Ƚ�ˮ���Ҵ����ǻ���Ļ�����ǿ�� | �ý����Ʒֱ���ˮ���Ҵ���Ӧ |
B | ��֤��CH2=CHCHO�к���̼̼˫�� | ��������KMnO4��Һ�����Ϻ�ɫ�Ƿ���ȥ |
C | ȷ��̼������Ԫ�طǽ����Ե�ǿ�� | �ⶨͬ��ͬŨ�ȵ�Na2CO3��NaClOˮ��Һ��pH |
D | ����ȥ���л��еı��� | ����Һ�м���Ũ��ˮ����ַ�Ӧ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com