
| A. | 磷酸的摩尔质量(以g/mol为单位)与NA 个磷酸分子的质量(以g为单位)在数值上相等 | |
| B. | NA个氮分子和NA个氢分子的质量比等于14:1 | |
| C. | 1 mol CH3+(碳正离子)中含有电子数为10 NA | |
| D. | 32g氧气所含的氧原子数目为2 NA |
分析 A、磷酸的摩尔质量为98g/mol,故1mol磷酸的质量为98g;
B、当物质的量相同时,物质的质量之比等于摩尔质量之比;
C、CH3+(碳正离子)中含8个电子;
D、氧气由氧原子构成.
解答 解:A、磷酸的摩尔质量为98g/mol,故1mol磷酸的质量为98g,而1mol磷酸中含NA个磷酸分子,故NA个磷酸分子的质量之和为98g,与磷酸的摩尔质量在数值上相同,故A正确;
B、NA个氮分子和NA个氢分子的物质的量均为1mol,而当物质的量相同时,物质的质量之比等于摩尔质量之比,故氮气和氢气的质量之比为28:2=14:1,故B正确;
C、CH3+(碳正离子)中含8个电子,故1mol碳正离子中含8NA个电子,故C错误;
D、氧气由氧原子构成,故32g氧气中含有的氧原子的物质的量为2mol,个数为2NA个,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
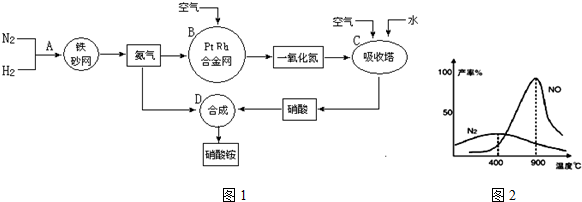
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①②③④ | C. | ②③⑤⑥ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发展太阳能发电、利用CO2制造全降解塑料都能有效减少环境污染 | |
| B. | 农业废弃物、城市工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 | |
| C. | 煤的干馏是将煤隔绝空气加强热,得到焦炭、煤焦油、焦炉气等 | |
| D. | 石油产品都可用于聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
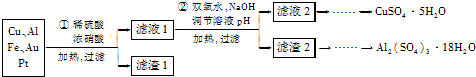
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取11.7gNaCl | |
| B. | 用50mL量筒量取21.48mL稀硫酸 | |
| C. | 用碱式滴定管量取25.03mLH2SO4溶液 | |
| D. | 用pH试纸测定HNO3溶液的pH=3.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com