
| A. | pH=7的溶液是中性 | |
| B. | 中性溶液中一定有c(H+)=1.0×10-7mol•L-1 | |
| C. | 在100℃时,纯水的pH<7,因此显酸性 | |
| D. | c(OH-)=c(H+)的溶液呈中性 |
分析 A.温度未知,不能根据pH大小判断溶液酸碱性;
B.常温下中性溶液中c(H+)=c(OH-)=1.0×10-7mol•L-1;
C.在100℃时,纯水呈中性.
D.任何水溶液中只要c(H+)=c(OH-),则该溶液一定呈中性.
解答 解:A.在100℃时,纯水的pH=6,呈中性,该温度下pH=7时溶液呈碱性,温度未知,不能根据pH大小判断溶液酸碱性,故A错误;
B.常温下中性溶液中c(H+)=c(OH-)=1.0×10-7mol•L-1,温度不知,中性溶液中不一定有c(H+)=1.0×10-7mol•L-1,故B错误;
C.在100℃时,纯水中存在c(H+)=c(OH-),仍然呈中性,故C错误;
D.任何水溶液中只要存在c(H+)=c(OH-),则该溶液一定呈中性,故D正确;
故选D.
点评 本题考查探究溶液酸碱性判断,为高频考点,要根据溶液中c(H+)、c(OH-)相对大小判断溶液酸碱性,温度未知时不能根据pH大小判断溶液酸碱性,易错选项是B,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | K+、NO3-、OH-、Cl- | B. | Cu2+、SO42-、H+、Na+ | ||
| C. | H+、Ba2+、Mg2+、NO3- | D. | NH4+、MnO4-、H+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
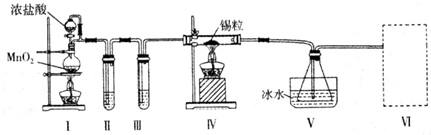
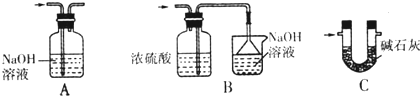
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |
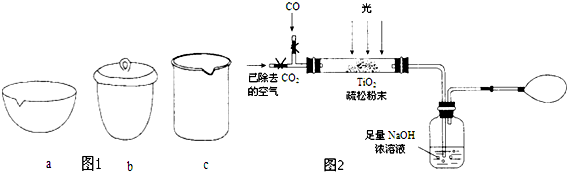
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为55 | B. | 电子数是55 | C. | 中子数是137 | D. | 质量数是137 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量:②>①>③ | B. | 氢原子数:②>①>③ | C. | 体积:②>①>③ | D. | 密度:②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
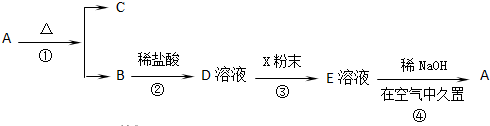
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com