
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
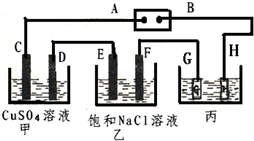 如图所示的装置,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液.在F极附近显红色.试回答以下问题:
如图所示的装置,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液.在F极附近显红色.试回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、1:1 |
| C、1:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 |
B、基态碳原子的价电子排布图: |
C、基态铜原子的价电子排布图: |
| D、Fe3+的最外层电子排布式为:3s23p63d5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体 系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出能量:23.15 kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A、容器①、②中反应达到平衡时所用的时间相等 |
| B、平衡时,两个容器中NH3的体积分数均为12.5% |
| C、容器②中达到平衡时放出的热量Q=23.15 kJ |
| D、若容器①体积为0.2 L,则平衡时放出的热量>23.15 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
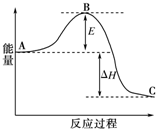 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1 mol任何物质的体积都约为22.4 L |
| B、1 mol任何气体所含分子数都相等,体积也都约为22.4 L |
| C、相同状况下,1 L CO一定比1 L O2的质量小 |
| D、在同温同压下,相同体积的任何气体单质所含原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸的摩尔质量是98g |
| B、标准状况下,22.4L的O2质量是32g |
| C、2gH2所含原子数目为1mol |
| D、铁原子的摩尔质量等于铁的相对原子质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com