
 .
.| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
分析 (1)①S是16号元素.S原子获得2个电子变为S2-,硫离子的结构示意图为: ;
;
②加热时,硫元素的最高价氧化物对应水化物的浓溶液是浓硫酸与木炭反应生成二氧化碳、二氧化硫和水;
(2)①HSO3-的电离方程式为:HSO3-?H++SO32-,平衡常数表达式为K=$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$;
②Na2SO3溶液显碱性,SO32-存在两步水解,以第一步水解为主,水解程度较小,据此判断离子浓度关系;
③由表可知H2SO3的二级电离小于H2CO3的一级电离,则酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,而不是为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O.
解答 解:(1)①S是16号元素.S原子获得2个电子变为S2-,硫离子的结构示意图为: ,故答案为:
,故答案为: ;
;
②加热时,硫元素的最高价氧化物对应水化物的浓溶液是浓硫酸与木炭反应生成二氧化碳、二氧化硫和水,反应的方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(2)①HSO3-的电离方程式为:HSO3-?H++SO32-,平衡常数表达式为K=$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$,
故答案为:$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$;
②Na2SO3溶液显碱性,SO32-存在两步水解:SO32-+H2O?HSO3-+OH-,HSO3-+H2O?H2SO3+OH-,以第一步水解为主,水解程度较小,则0.1mol/L Na2SO3溶液中的离子浓度顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),故答案为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
③由表可知H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,而不是为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O,
故答案为:H2SO3+HCO3-=HSO3-+CO2↑+H2O.
点评 本题考查元素原子结构示意图的书写、物质性质的化学方程式书写、盐的水解平衡、弱电解质电离平衡的知识在离子浓度大小比较的应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁片与稀盐酸制取H2:2Fe+6H+═2Fe3++3H2↑ | |
| B. | HNO3溶液中加入NaOH溶液:H++OH-═H2O | |
| C. | 向硫酸铁溶液中加入铁钉:Fe3++Fe═2Fe2+ | |
| D. | 向AlCl3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
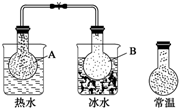 已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )| A. | 反应2NO2(g)?N2O4(g)的正反应为吸热反应 | |
| B. | 上述过程中,A烧瓶内正、逆反应速率均加快 | |
| C. | 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 | |
| D. | 上述过程中,A、B烧瓶内气体密度均保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.1 mol•L-1 | |
| B. | 实验③中的沉淀中一定有BaSO4,可能有Mg(OH)2 | |
| C. | 若要判断原溶液中是否有Cl-,无需另外设计实验验证 | |
| D. | 原溶液中一定有K+,且c(K+)≥0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
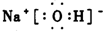 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com