
| A. | 一定有新的物质生成 | |
| B. | 必然发生旧化学键断裂,新化学键形成 | |
| C. | 原子的数目可能有变化 | |
| D. | 必然伴随着能量的变化 |
分析 化学反应中一定有新物质生成,遵循能量守恒及质量守恒,存在能量变化与化学键有关,以此来解答.
解答 解:A.化学变化中一定有新物质生成,没有新物质生成的变化为物理变化,故A正确;
B.化学反应中一定存在能量变化,断裂化学键吸收能量,形成化学键释放能量,则化学变化中必然发生旧化学键断裂,新化学键形成,故B正确;
C.由质量守恒定律可知,化学变化中原子的数目不变,故C错误;
D.化学反应中必然发生旧化学键断裂,新化学键形成,断裂化学键吸收能量,形成化学键释放能量,可知化学反应必然伴随着能量的变化,故D正确;
故选C.
点评 本题考查化学键及化学反应中能量变化等,为高频考点,把握化学反应的实质及化学键与能量变化的关系为解答的关键,注意化学反应中能量守恒及质量守恒关系,题目难度不大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2+、H+、SO32-、ClO- | B. | Na+、Cu2+、Cl-、SO42- | ||
| C. | Pb2+、NH4+、Cl-、CH3CHOO- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
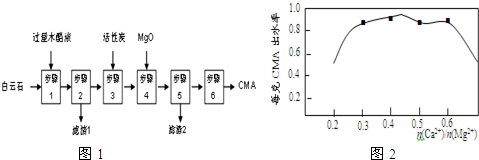
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
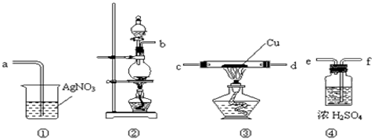
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
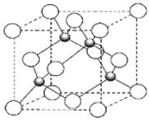 X、Z、Q、R、T为前四周期元素,且原子序数依次增大.X和Q属同族元素,X和R可形成化合物XR4;R2为黄绿色气体;Z与X同周期且基态原子的s轨道和p轨道的电子总数相等;T2+的3d 轨道中有5个电子.请回答下列问题:
X、Z、Q、R、T为前四周期元素,且原子序数依次增大.X和Q属同族元素,X和R可形成化合物XR4;R2为黄绿色气体;Z与X同周期且基态原子的s轨道和p轨道的电子总数相等;T2+的3d 轨道中有5个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | |
| B. | 1L0.1mol•L-1 CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 常温下,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时:c(NH4+)=2c(SO42-) | |
| D. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 向Mg(HCO3)2溶液中加入过量澄清石灰水:Mg2++2HCO3-+2OH-+Ca2+=MgCO3↓+CaCO3↓+2H2O | |
| C. | 氧化铁溶氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O | |
| D. | 明矾溶液与Ba(OH)2溶液混合:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列最外层电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、O、S ③Si、P、As ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ | |
| D. | 某元素基态原子的逐级电离能分别为578、1817、2745、11575、14830、18376、23293,当它与氯气反应时可能生成的阳离子是X2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com