
科目:高中化学 来源: 题型:
在25℃时,将气体X、Y放入密闭容器中发生反应生成Z,5min后达到平衡.其初始浓度和平衡浓度如下表:
|
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省泰州市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.Hg(l) + H2SO4(aq) = HgSO4(aq) + H2(g)常温下不能自发进行,说明△H<0
B.用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度
C.已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度
D.25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A.该反应可表示为X+3Y?2Z |
| B.反应达到平衡时,X的转化率为50% |
| C.前5min 以Y表示的平均反应速率为υ(Y)=0.01 mol?L-1?min-1 |
| D.增大压强使平衡向生成Z的方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)水的离子积常数K![]() 与温度t(℃)的关系如右图所示:
与温度t(℃)的关系如右图所示:
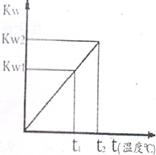
(1)若![]() ℃,则K
℃,则K![]() =_________;若
=_________;若![]() ℃时,则100℃时,0.05
℃时,则100℃时,0.05![]() 的Ba(OH)
的Ba(OH)![]() 溶液的pH=__________。
溶液的pH=__________。
(2)已知25℃时,![]() 的NaA溶液的pH=10,则NaA溶液中所存在的化学平衡有(离子方程式表示):__________。溶液中各离子的物质的量浓度由大到小的顺序为___________。
的NaA溶液的pH=10,则NaA溶液中所存在的化学平衡有(离子方程式表示):__________。溶液中各离子的物质的量浓度由大到小的顺序为___________。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为____________________。
(4)100℃时,若10体积的pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合之前,a与b之间应满足的关系为:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com