
【题目】对于放热反应H2 + Cl2![]() 2HCl,下列说法正确的是:
2HCl,下列说法正确的是:
A.产物所具有的总能量高于反应物所具有的总能量
B.反应物所具有的总能量高于产物所具有的总能量
C.断开1mol H—H键和1mol Cl—Cl键所吸收的总能量小于形成1mol H—Cl键所放出的能量
D.该反应中,化学能只有转变为热能
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】肼(分子式 N2H4,沸点 113.5℃)是一种良好的火箭燃料,是一种易溶 于水和醇类等有机溶剂的无色油状液体。在工业上有重要用途。实验室可用如下 装置(略去部分夹持装置)模拟利用氨气和次氯酸钠合成肼的过程。

(1)装置 A 可用来制备 Cl2,装置 B 中饱和食盐水的作用是_____,当合成肼的反应结束时关闭止水夹 K1,装置 B 可以观察到的实验现象_____。
(2)装置 C 中长玻璃导管 b 与装置 B 中的_____(填仪器名称)的作用相同。
(3)装置 E 中可用熟石灰和氯化铵制备 NH3,反应的化学方程式为_____
(4)当反应一段时间,关闭两个止水夹,打开装置 C 中分液漏斗的活塞,将溶液 全部滴入集气瓶中,反应生成肼。反应的离子方程式为_____。 有同学说装置 D 没有什么作用,若去掉装置 D,对实验是否有影响?请说明理由:___________。
(5)将足量的 Cl2 与含有 0.4mol NaOH 的水溶液反应,分液漏斗中液体全部滴入 C 中,并向 C 中通入标准状况下的 13.44L NH3,从 C 中蒸馏分离得到 3.6g 液态肼, 则该实验中肼的实验产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种常见药物①阿司匹林②青霉素③胃舒平④麻黄碱。请回答:
(1)某同学胃酸过多,应选用的药物是___(填序号),抗酸药的成分Al(OH)3中和胃酸过多的离子方程式为___。
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是___(填序号,下同)。
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是___。
(4)阿司匹林药品标签上贴有OTC,它表示___, 滥用药物会导致不良后果,如过量服用___会出现水杨酸中毒,应立即停药,并静脉注射NaHCO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,含有以下离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,现取两份100mL的该溶液进行如下实验:
,现取两份100mL的该溶液进行如下实验:
(1)第一份加足量NaOH溶液,加热,收集到标准状况下的气体448mL;
(2)第二份加足量![]() 溶液,得沉淀
溶液,得沉淀![]() ,再用足量盐酸洗涤、干燥后,沉淀质量为
,再用足量盐酸洗涤、干燥后,沉淀质量为![]() .
.
根据上述实验,下列推测正确的是![]()
A.![]() 一定存在
一定存在
B.100mL该溶液中含![]()
C.![]() 不一定存在
不一定存在
D.![]() 不确定,可向原溶液中加入
不确定,可向原溶液中加入![]() 溶液进行检验
溶液进行检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,取10 mL 0.1 molL1某二元酸H2A,滴加0.1 molL1 NaOH溶液。已知:H2A=H+ + HA-,HA-![]() H+ + A2-。下列说法正确的是
H+ + A2-。下列说法正确的是
A.A2-可经过两步水解得到H2A
B.当用去NaOH溶液体积10 mL时,溶液中离子浓度大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.当滴加至中性时,溶液中有c(Na+)=c(HA-) + c(A2-)
D.当用去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=c(HA-) + c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图所示(加热、搅拌和仪器固定装置均已略去)。

实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中;
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2∶1.5)溶液;
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体;
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
(1)检验淀粉是否水解完全所需用的试剂为________;
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是_________;
(3)装置C用于尾气吸收,当尾气中n(NO2)∶n(NO)=1∶1时,过量的NaOH溶液能将NO,全部吸收,原因是_________(用化学方程式表示);
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是________;
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中能大量共存的是( )
A.遇甲基橙变红的溶液中:K+、Na+、Cl-、SiO32-
B.0.1molL-1NaA1O2溶液中:Na+、NO3-、NH4+、HCO3-
C.常温下,![]() =1012的溶液中:SO32-、SO42-、Na+、Br-
=1012的溶液中:SO32-、SO42-、Na+、Br-
D.澄清透明的溶液中:Fe3+、A13+、I-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿粉末(主要成分MnO2,还含有Al2O3、Fe2O3等杂质)为原料制MnSO4·H2O的工艺流程如下:
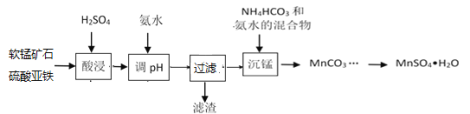
已知:pH>3.3后溶液不存在Fe3+,pH>5.0后溶液不存在Al3+,pH>8后Mn2+开始沉淀。
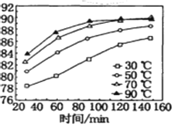
(1)保持其他条件不变,在不同温度下对含软锰矿粉进行酸浸,锰浸出率随时间变化如图。酸浸的最佳温度与时间分别为________℃、______min。
(2)“酸浸”时,会将Fe2+氧化至Fe3+,所发生的反应离子方程式为__________。
(3)酸浸时要加入硫酸,硫酸浓度不能过大或者过小。当硫酸浓度过小时,酸浸会有红褐色残渣出现,原因是_____________________________。
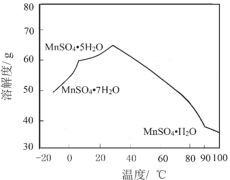
(4)MnSO4在水中的溶解度与温度关系如图。由MnCO3获得较纯净的MnSO4H2O晶体的方法是:将MnCO3溶于_________,控制温度为_________以上结晶,得到MnSO4H2O晶体,洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com