
| A. | 实验室可用电石与蒸馏水制乙炔 | |
| B. | 苯与液溴反应时,要加入铁粉,所以真正起到催化作用的是铁粉 | |
| C. | 石油裂化的目的是为了提高汽油的产量和质量 | |
| D. | 说明苯分子中的碳碳键不是单、双键交替的事实是苯的邻位二取代物只有一种 |
分析 A.电石和蒸馏水发生反应生成氢氧化钙和乙炔气体;
B.苯与液溴反应时,要加入铁粉,起催化作用的是溴化铁;
C.因石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,相对分子质量大、沸点高的分子分解为相对分子质量小、沸点低的分子;
D.如果是单双键交替结构,苯的邻二氯苯应有两种同分异构体,但实际上只有一种结构,能说明苯环结构中的化学键只有一种.
解答 解:A.电石和蒸馏水发生反应生成氢氧化钙和乙炔气体,实验室可用电石与蒸馏水制乙炔,故A正确;
B.苯与液溴反应时,要加入铁粉,铁先和溴单质反应生成溴化铁,起催化作用的是溴化铁而不是铁,故B错误;
C.因石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量和质量,故C正确;
D.如果是单双键交替结构,苯的邻位二氯取代物应有两种同分异构体,但实际上只有一种结构,能说明苯环结构中的化学键只有一种,不存在C-C单键与C=C双键的交替结构,故D正确;
故选B.
点评 本题考查了苯、乙炔、石油等物质的性质、制备和应用,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2LH2中含有的氢原子一定为1mol | |
| B. | 16gCH4在标准状况下的体积约为22.4L | |
| C. | 71gCl2中含有的氯原子数约为6.02×1023 | |
| D. | 1L 0.5 mol/LBaCl2溶液中Cl-的物质的量浓度为0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸和NaOH溶液反应 | B. | 氯化氢溶于水 | ||
| C. | 稀硫酸与BaCl2溶液反应 | D. | 氯化氢与氨气反应生成NH4Cl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
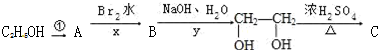
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
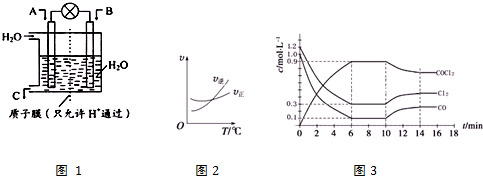
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
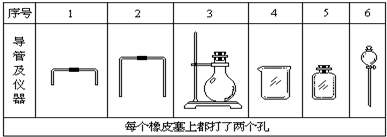
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变 | |
| B. | 利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂 | |
| C. | 利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟 | |
| D. | 利用高锰酸钾溶液的氧化性,催熟水果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com