
 3Z(g)+2W(g),该X、Y的初始浓度分别为3.0 mol·L-1和1.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是 ( )
3Z(g)+2W(g),该X、Y的初始浓度分别为3.0 mol·L-1和1.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是 ( )  天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.生成1mol乙酸乙酯的同时,也生成1mol乙酸 |
| B.乙酸、乙醇、乙酸乙酯的浓度相同 |
| C.当乙酸断开1mol碳氧单键的同时,乙醇也断开了1mol氢氧键 |
| D.当乙酸断开1mol氢氧键的同时,乙醇也断开了1mol碳氧单键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NO2 (g)在下列过程中发生的变化描述正确的是
2NO2 (g)在下列过程中发生的变化描述正确的是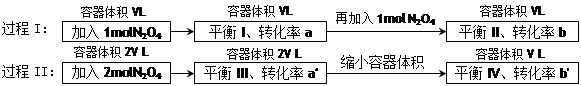
| A.a' < b'、a > b | B.在平衡I向平衡II过渡的过程中,v(逆) < v(正) |
| C.a' > a、b' < b | D.平衡II与平衡IV中N2O4的质量分数相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为
2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为| A.2:1 | B.1:1 | C.2:3 | D.3:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



 △H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答
△H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答 :
:
 在前10min内,用CO2表示的反应速率
在前10min内,用CO2表示的反应速率 (CO2)="________"
(CO2)="________"  a.容器压强不变 b.混合气体中c(CO2)不变
a.容器压强不变 b.混合气体中c(CO2)不变 (CH3OH)=
(CH3OH)=  (H2O) d.c(CH3
(H2O) d.c(CH3 OH)=c(H2O)
OH)=c(H2O) (3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O
H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O 的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。请回答下面两个问题:
的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。请回答下面两个问题: 低)。高压锅中水的沸点比普通锅中水的沸点 (填高或低)。
低)。高压锅中水的沸点比普通锅中水的沸点 (填高或低)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
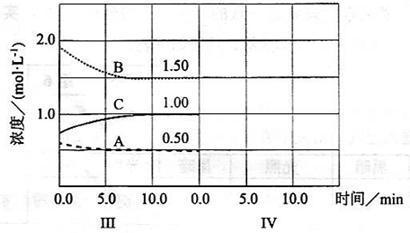
 cC(g)(
cC(g)(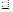 H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示: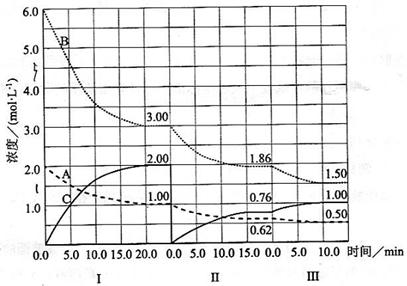
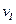 (A)、
(A)、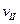 (A)、
(A)、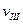 (A)从大到小排列次序为 ;
(A)从大到小排列次序为 ;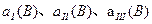 中最小的是 ,其值是 ;
中最小的是 ,其值是 ;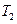 )和第III阶段反应速度(
)和第III阶段反应速度( )的高低:
)的高低: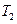

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com