
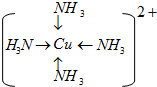 .
.分析 (1)向CuSO4溶液中逐滴加入氨水,生成氢氧化铜沉淀,再加氨水可形成铜氨配合离子,沉淀溶解,若加入乙醇,乙醇能降低[Cu(NH3)4]SO4的溶解度;铜离子与配体氨分子形成配位键,据此写出其结构;
(2)在BF3分子中,B原子最外层价电子数对为$\frac{3+3}{2}$=3,所以B原子按sp2方式杂化,据此判断键角,根据相似相溶原理分析溶解性,BF3与F-通过配位键形成BF4-;
(3)石墨结构中层内碳原子之间以共价键作用,层间为分子间作用为,据此答题;
(4)根据金刚石的晶胞结构利用均摊法判断晶胞中原子数目,根据$ρ=\frac{m}{V}$ 计算密度.
解答 解:(1)向CuSO4溶液中逐滴加入氨水,生成氢氧化铜沉淀,反应的离子方程式为Cu2++2NH3.H2O=Cu(OH)2+2NH4+,再加氨水可形成铜氨配合离子,沉淀溶解,若加入乙醇,乙醇能降低[Cu(NH3)4]SO4的溶解度,溶液中有蓝色晶体生成;铜离子与配体氨分子形成配位键,其结构为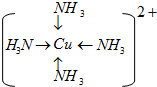 ,
,
故答案为:Cu2++2NH3.H2O=Cu(OH)2+2NH4+;有蓝色晶体生成;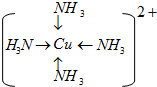 ;
;
(2)在BF3分子中,B原子最外层价电子数对为$\frac{3+3}{2}$=3,所以B原子按sp2方式杂化,所以F-B-F的键角是120°,BF3和苯都是非极性分子,根据相似相溶原理,BF3可溶于苯中,BF3与F-通过配位键形成BF4-,其结构与铵根离子相似,所以其立体结构为正四面体,
故答案为:120°;BF3和苯都是非极性分子,根据相似相溶原理;正四面体;
(3)石墨结构中层内碳原子之间以共价键作用,层间为分子间作用为,所以六方氮化硼晶体中,层内B原子与N原子之间的化学键类型为极性共价键或共价键,层间作用力为分子间作用力,
故答案为:极性共价键或共价键;分子间作用力;
(4)金刚石晶胞是立方体,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,所以金刚石的一个晶胞中含有的碳原子数=8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子.一个晶胞中的质量为$\frac{25g}{{N}_{A}}$,一个立方氮化硼晶胞的体积是(361.5pm)3,因此立方氮化硼的密度是 $\frac{25×4}{{({\;}\right.361.5×{{10}^{-10}}{{\left.{\;})}^3}×{N_A}}}$g•pm-3,
故答案为:4;4; $\frac{25×4}{{({\;}\right.361.5×{{10}^{-10}}{{\left.{\;})}^3}×{N_A}}}$.
点评 本题考查较为全面,涉及到配合物的结构、配合物的形成以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意基础知识和规律的应用,中等难度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
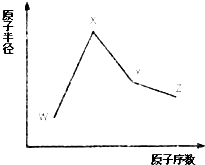 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.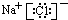 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为($\frac{7}{22.4}$)NA | |
| B. | 1mol羟基(-OH)所含的电子总数为10NA | |
| C. | 硝化甘油、火棉、TNT都是硝酸酯 | |
| D. | 1mol碳正离子(CH3+)所含的电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NH3溶解度比I2的溶解度大 | NH3是极性分子,I2是非极性分子 |
| B | 通常条件下,HCl比HI稳定性高 | 非金属性:Cl>I |
| C | NH2OH中N的化合价为:-3 | 电负性:Cl>N |
| D | 沸点:SiO2>CO2 | 式量:SiO2>CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往95%酒精中加入无水氯化钙,蒸馏得到无水乙醇 | |
| B. | 往2mL 10% CuSO4 溶液中滴加几滴2% NaOH,然后滴加少量乙醛,加热制得砖红色沉淀Cu2O | |
| C. | 用氯气和乙烷按1:1体积比混合,光照条件下,制纯一氯乙烷 | |
| D. | 往装有电石的烧瓶中逐滴滴加饱和食盐水,制粗乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时,温度计水银球的位置应插入烧瓶的溶液中 | |
| B. | 配制溶液时,摇匀后发现液面低于刻度,加少量水至溶液凹液面恰好与刻度线相切 | |
| C. | 容量瓶用蒸馏水清洗后应烘干后使用 | |
| D. | 实验室制取蒸馏水时,冷凝管水流方向应从下到上,与蒸汽流动方向相反 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com