解:(1)亚铁离子既能被氧化,又能被还原,故C正确,故选C;
(2)向沸水中逐滴滴加1 mol/L FeCl
3溶液,至液体呈透明的红褐色,形成了胶体,胶体粒子直径范围是1~100nm,故答案为:1~100;
(3)FeCl
3溶液与铜反应的离子方程式是:2Fe
3++Cu═2Fe
2++Cu
2+;由于滴入KSCN溶液呈红色,证明溶液中Fe
3+有剩余,溶液中含有的金属阳离子是:Fe
3+Fe
2+Cu
2+;
43.05g沉淀是氯化银,物质的量为0.3mol,溶液中c(Cl
-)=
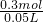
=6.0mol/L;
故答案为:2Fe
3++Cu═2Fe
2++Cu
2+;Fe
3+Fe
2+Cu
2+;6.0;
(4)A、向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe
3+,故A错误;
B、向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe
2+;故B正确;
C、试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe
2+,应该是先加入硫氰化钾,不变色,再加入氯水,若显示红色,证明有亚铁离子,故C错误;
故选B;
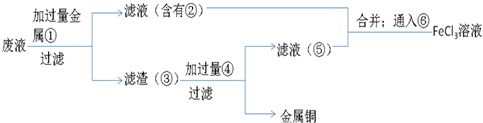
(5)A、制取的是氯化铁溶液,金属①是铁;滤液②是氯化亚铁溶液;加入的铁过量,滤渣③是铁和铜;制取的是氯化铁,溶解铁,④加入应该是盐酸;
故答案为:Fe;FeCl
2;Fe Cu;HCl;
B、⑥是将亚铁离子氧化成三价铁离子,反应方程式是:2FeCl
2+Cl
2=2FeCl
3,故答案为:2FeCl
2+Cl
2=2FeCl
3.
分析:(1)含元素的化合价既能升高,又能降低的物质;
(2)胶体的粒子大小范围是:1~100;
(3)FeCl
3溶液与铜反应:2Fe
3++Cu═2Fe
2++Cu
2+; 滴入KSCN溶液呈红色,存在三价铁离子;沉淀43.05g是氯化银,物质的量是0.3mol;
(4)检验的Fe
2+方法;
(5)A、根据图示进行推断,金属是铁;
B、亚铁离子氧化成三价铁离子.
点评:本题考查了铁及其化合物的性质,涉及的内容较多,注意分析题中提供的信息,根据所学知识写成反应的方程式,本题难度中等.

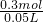 =6.0mol/L;
=6.0mol/L;

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案