
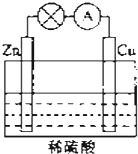
 电能是现代社会应用最广泛的能源之一.如图所示的原电池装置中,其负极是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑.原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.
电能是现代社会应用最广泛的能源之一.如图所示的原电池装置中,其负极是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑.原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g. 分析 根据锌比铜活泼,所以锌作负极,氢离子在正极Cu上得电子生成氢气,根据消耗的金属的量计算生成气体的量.
解答 解:由于锌比铜活泼,所以锌作负极,所以消耗的金属为锌.
锌失电子生成锌离子进入溶液,电极反应式为锌片:Zn-2e-=Zn2+,铜片上氢离子得电子生成氢气,所以电极反应式为2H++2e-=H2↑,
总反应:Zn+2H+=H2↑+Zn2+
65g 2g
6.5g Xg
$\frac{65g}{6.5g}$=$\frac{2g}{Xg}$
解得X为0.2g.
故答案为:Zn;铜片表面产生无色气泡; 2H++2e-=H2↑;0.2.
点评 本题以原电池为载体考查了有关计算,明确各物理量之间的关系是解本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 25% | C. | 50% | D. | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酸性强弱:H3PO4<H2SO4 | B. | 稳定性:HF>H2S | ||
| C. | 碱性:Ca(OH)2<Mg(OH)2 | D. | 非金属性:N<Si |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl+H2O;反应的化学方程式:
+NaCl+H2O;反应的化学方程式: +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl+H2O.
+NaCl+H2O.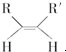 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO,请写出下列反应产物的结构简式:
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO,请写出下列反应产物的结构简式: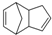 $\stackrel{O3}{→}$$\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O3}{→}$$\stackrel{H_{2}O/Zn}{→}$ ;
;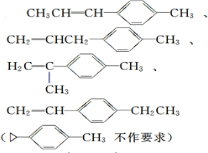 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
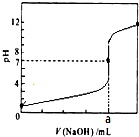 常温下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LHCl溶液,滴定曲线,如图所示.下列说法不正确的是( )
常温下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LHCl溶液,滴定曲线,如图所示.下列说法不正确的是( )| A. | a=20.00 | |
| B. | 滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-) | |
| C. | 若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 | |
| D. | 若将盐酸换成同浓度的醋酸,则滴定到pH=7时,a<20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度 | 250 | 300 | 350 |
| K | 2.041 | 0.250 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4 | C2H6 | C5H12 | C8H18 | … | … | … |
| A. | C26H54 | B. | C17H36 | C. | C80H162 | D. | C106H214 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品.
我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品. ①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;
①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com