
| A. | 1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L | |
| B. | 1 mol臭氧和1.5 mol氧气含有相同的氧原子数 | |
| C. | 等体积、浓度均为1 mol•L-1的磷酸和盐酸,H3PO4和HCl含有的氢元素质量之比为1:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$=cV结合物质的构成计算.
解答 解:A.n(O)=$\frac{12.04×1{0}^{23}}{6.02×1{0}^{23}/mol}$=2mol,则n(O2)=1mol,体积为22.4L,故A正确;
B.1 mol臭氧和1.5 mol氧气都含有3molO原子,数目相同,故B正确;
C.等体积、浓度均为1 mol•L-1的磷酸和盐酸,H3PO4和HCl的物质的量相等,则含有的氢元素质量之比为3:1,故C错误;
D.由化学式可知等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3,故D正确.
故选C.
点评 本题综合考查物质的量的相关计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握物质的构成特点,难度中等.


科目:高中化学 来源: 题型:解答题
 ;试用电子式表示原子个数比为2:1的该化合物的形成过程
;试用电子式表示原子个数比为2:1的该化合物的形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 电离常数 酸 | K1 | K2 |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
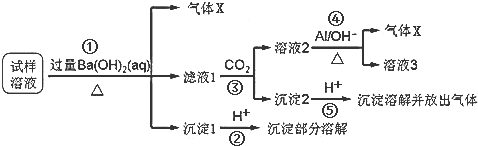
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由该氯原子构成氯分子(Cl2)的相对分子质量为$\frac{24a}{b}$ | |
| B. | mg该氯原子的物质的量为$\frac{m}{aNA}$ mol | |
| C. | ng该氯原子所含的电子数为$\frac{17n}{aNA}$ | |
| D. | 1mol该氯原子的质量为aNA g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯在常温下可与溴水发生取代反应 | |
| B. | 葡萄糖能发生氧化反应和银镜反应 | |
| C. | 乙醇和乙酸都能与氢氧化钠反应 | |
| D. | 糖类、油脂和蛋白质都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组同学研究了氧族元素及其某些化合物的部分性质,查阅资料如下:
某兴趣小组同学研究了氧族元素及其某些化合物的部分性质,查阅资料如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
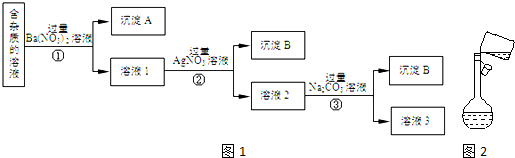
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com