
【题目】钼酸钠(Na2MoO4)是一种冷却水系统的金属缓蚀剂,工业上利用钼精矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如下图所示。
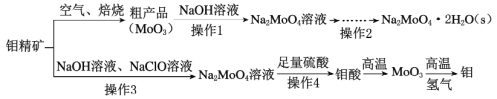
回答下列问题:
(1)如果在空气中焙烧1mol MoS2时,S转移12mol电子,则MoS2中钼元素的化合价为____;焙烧产生的尾气对环境的主要危害是___。
(2)若在实验室中进行操作2,则从钼酸钠溶液中得到钼酸钠晶体的操作步骤是_,过滤、洗涤、干燥。
(3)钼精矿中MoS2含量的测定:取钼精矿16g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体(Na2MoO4·2H2O)12.1g(假设各步的转化率均为100%),钼精矿中MoS2的质量分数为_________。(已知MoS2的相对分子质量为160,Na2MoO4·2H2O的相对分子质量为242)。
(4)操作3硫元素被氧化为最高价,发生反应的离子方程式为_______。
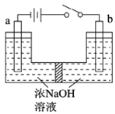
(5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如图所示。b电极上的电极反应式为____________。
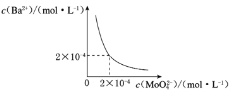
(6)某温度下,BaMoO4在水中的沉淀溶解平衡曲线如图所示,该温度下BaMoO4的Ksp的值为____。
【答案】+4 形成酸雨 加热浓缩(或蒸发浓缩)、冷却结晶 50% MoS2+6OHˉ+9ClO-=![]() +2
+2![]() +9Clˉ+3H2O Mo-6eˉ+8OHˉ=
+9Clˉ+3H2O Mo-6eˉ+8OHˉ=![]() +4H2O 4×10-8
+4H2O 4×10-8
【解析】
制备钼酸钠:钼精矿(主要成分为MoS2)在空气中焙烧得到MoO3,根据S元素的价态变化规律可知S元素被氧化成二氧化硫;然后MoO3用NaOH溶液溶解,过滤分离出难溶物,得到Na2MoO4溶液;经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到Na2MoO4.2H2O;
制备钼单质:钼精矿(主要成分为MoS2)经碱浸并用NaClO氧化,过滤得到Na2MoO4溶液,加入足量硫酸得到钼酸沉淀,过滤后经高温灼烧得到MoO3,氢气还原MoO3得到Mo。
(1)如果在空气中焙烧1molMoS2时,S转移12mol电子,根据电子守恒:(+4-x)×2=12,解得x=-2,所以MoS2中硫元素为-2价,钼元素的化合价为+4;焙烧的产物除MoO3外的另一种是SO2,产生的尾气对环境的主要危害是形成酸雨;
(2)在实验室中进行操作2,从钼酸钠溶液中得到钼酸钠晶体的操作步骤是加热浓缩(或蒸发浓缩)、冷却结晶,过滤、洗涤、干燥;
(3)设钼精矿中MoS2的质量分数为w,根据元素守恒可得关系式
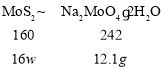
所以160:16w=242:12.1g,解得w=0.5,所以钼精矿中MoS2的质量分数为50%;
(4)根据题意可知NaClO将MoS2 氧化生成![]() 和
和![]() ,自身被还原成Clˉ,MoS2整体化合价升高18价,NaClO降低2价,所以二者的系数比为1:9,再结合元素可得发生反应的离子方程式为MoS2+6OHˉ+9ClOˉ=
,自身被还原成Clˉ,MoS2整体化合价升高18价,NaClO降低2价,所以二者的系数比为1:9,再结合元素可得发生反应的离子方程式为MoS2+6OHˉ+9ClOˉ=![]() +2
+2![]() +9Clˉ+3H2O;
+9Clˉ+3H2O;
(5)b与电源正极相连,为阳极,所以钼得电子发生氧化反应,在碱性环境中生成Na2MoO4,根据电荷守恒和电子守恒可得电极反应式为Mo-6eˉ+8OHˉ=![]() +4H2O;
+4H2O;
(6)据图可知c(Ba2+)= 2×10-4mol/L时,c(![]() )==2×10-4mol/L,所以BaMoO4的Ksp=c(Ba2+)c(
)==2×10-4mol/L,所以BaMoO4的Ksp=c(Ba2+)c(![]() )==2×10-4×2×10-4= 4×10-8;
)==2×10-4×2×10-4= 4×10-8;


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】25°C时,向10mL0.10mol·L-1的一元弱酸HA(Ka =1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( )
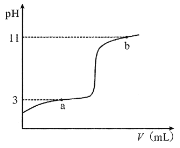
A.a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在a点和b点时水的电离程度相同
C.b点时,c(Na+)=c(HA)+c(A- )+c(OH-)
D.V =10mL时,c(Na+)>c(A-)>c(H+)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.自来水中通入少量Cl2用于杀菌、消毒是利用了Cl2能杀菌、消毒
B.漂白粉的主要成分是Ca(ClO)2,可用于杀菌、消毒
C.漂白粉是由Cl2和NaOH浓溶液制得
D.漂白粉与空气中的CO2和H2O反应而失效,因此要密封保存在干燥阴凉处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同浓度、温度条件下,蔗糖水解的瞬时速率如表。下列判断不正确的是
c/mol·L-1 v/mmol·L-1·min-1 T/K | 0.600 | 0.500 | 0.400 | 0.300 |
318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
328.2 | 9.00 | 7.50 | a | 4.50 |
b | 2.16 | 1.80 | 1.44 | 1.08 |
A.a=6.00
B.b<318.2
C.不同温度时,蔗糖浓度减少一半所需的时间不同
D.同时改变反应温度和蔗糖的浓度,蔗糖水解的瞬时速率一定改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A.0.1 mol氯气通入水中,转移电子的数目为0.1NA
B.常温常压下,7.8 g过氧化钠中含有阴离子的数目为0.2NA
C.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
D.标准状况下,22.4L C12与足量的铁充分反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如图的实验装置:
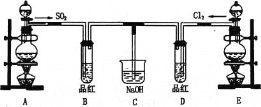
(1)实验室用装置A,用浓硫酸和铜反应制备SO2,请写出化学反应方程式____________
(2)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B_____、D______,停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B_____、D______。
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向废水中加入硫化物可以依次获得CuS、ZnS纳米粒子。常温下,H2S![]() Ka1=1.3×10-7,Ka2=7.1×10-15,溶液中平衡时相关离子浓度的关系如图,下列说法错误的是
Ka1=1.3×10-7,Ka2=7.1×10-15,溶液中平衡时相关离子浓度的关系如图,下列说法错误的是
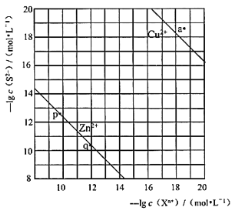
A.Ksp(CuS)的数量级为10-37
B.a点对应的CuS溶液为不饱和溶液
C.向p点的溶液中加入少量Na2S固体,溶液组成由p向q方向移动
D.H2S+Zn2+ ![]() ZnS + 2H+平衡常数很大,反应趋于完全
ZnS + 2H+平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
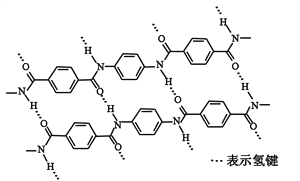
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液。
(1)该学生指示剂和装标准液的仪器选用正确的一组是___(写编号)
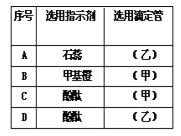

(2)该同学滴定操作的正确顺序是(用序号填写):( )→( )→d→( )→( )→( )→f___
a.用酸式滴定管取盐酸溶液25.00mL,注入锥形瓶中,加入指示剂
b.用蒸馏水洗干净滴定管
c.用待测定的溶液润洗酸式滴定管
d.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度"0"以上2~3 cm处,再把碱式滴定管固定好,调节液面至度"0"或“0”刻度以下
e.检查滴定管是否漏水。
f.另取锥形瓶,再重复操作一次
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
(3)实验中用左手控制___(填仪器及部位),眼睛注视__,直至滴定终点。判断到达终点的现象是__。
(4)已知滴定管中装有浓度为0.1000mol/L的氢氧化钠.逐滴加入到装有盐酸溶液的锥形瓶中。开始时读数及恰好反应时氢氧化钠溶液的读数见表。
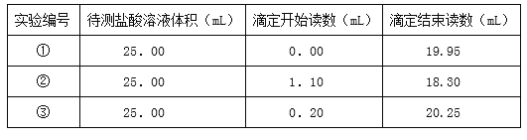
请计算待测的盐酸的物质的量浓度___。
(5)下面操作会导致待测盐酸的浓度偏大的是___(写编号)。
a.其它操作均正确,滴定终点读数时,仰视滴定管的刻度
b.盛装待测液的锥形瓶用水洗后未用所装待测液润洗
c.盛装标准液的碱式滴定管未用标准液洗
d.盛装待测液的酸式滴定管未用待测液润洗
e.配制标准溶液时,称取的NaOH固体中含少量KOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com