
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ |
 ,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).
,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示). ,
,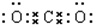 .
.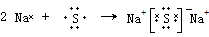 该化合物属于离子(填“共价”或“离子”)化合物.
该化合物属于离子(填“共价”或“离子”)化合物.分析 由元素在周期表中位置,可知①为C、②为O、③为F、④为Na、⑤为P、⑥为S、⑦为Cl、⑧为K.
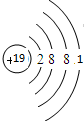
(1)同一周期元素中,元素的金属性随着原子序数的增大而减弱,同一主族中,元素的金属性随着原子序数的增大而增强;最活泼金属元素为钾元素,根据原子的核外电子排布情况绘制钾原子的原子结构示意图,元素的非金属性越强,其最高价氧化物的水化物酸性越强(O、F元素除外),最高价氧化物对应的水化物中,酸性最强的是Cl;
(2)非金属性越强,形成的氢化物越稳定;
(3)②为O、④为Na组成的某种化合物为Na2O2,①与②组成的某种化合物为CO2,反应生成氧气,Na2O2是钠离子和过氧根离子构成的离子化合物,二氧化碳分子中每个氧原子和碳原子形成两个共用电子对;
(4)④为Na、⑥为S,两者形成离子化合物硫化钠,根据硫化钠为离子化合物,离子和原子都满足8电子稳定结构,书写离子键形成过程;
(5)分别与冷水反应,K与水的反应现象更剧烈;
(6)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱.
解答 解:(1)同一周期元素中,元素的金属性随着原子序数的增大而减弱,同一主族中,元素的金属性随着原子序数的增大而增强,所以金属性最强的元素是K,钾为19号元素,原子结构示意图为: ,最高价氧化物对应的水化物酸性最强的是非金属性最强的氯,对应的高氯酸,
,最高价氧化物对应的水化物酸性最强的是非金属性最强的氯,对应的高氯酸,
故答案为: ;HClO4;
;HClO4;
(2)②为O、③为F、⑤为P、⑥为S、⑦为Cl,非金属性最强的元素为F,其形成的氢化物HF最稳定,
故答案为:HF;
(3)Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,二氧化碳为共价化合物,分子中存在两个碳氧双键,二氧化碳的电子式为
,二氧化碳为共价化合物,分子中存在两个碳氧双键,二氧化碳的电子式为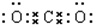 ,
,
故答案为: ;
;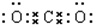 ;
;
(4)硫化钠为离子化合物,离子和原子都满足8电子稳定结构,离子键形成过程为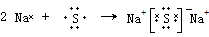
故答案为: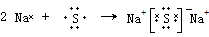
(5)金属与水反应越剧烈,金属性越强,钠和钾分别与冷水反应,钾反应更剧烈,所以分别与冷水反应,K与水的反应现象更剧烈,则钠比钾金属性的弱,
故答案为:分别与冷水反应,K与水的反应现象更剧烈,则钠比钾金属性的弱;
(6)单质与氢气化合越容易,则元素的非金属性越强,可以判断非金属性强弱,比较⑥与⑦非金属性强弱,可设计Cl2、S分别与H2反应,与氢气反应越剧烈,对应单质的元素的非金属性越强,氯气氧化性大于硫,可置换出硫,硫化钠和氯气的离子反应方程式Cl2+S2-﹦2Cl-+S,氯的非金属性大于硫,
故答案为:Cl2、S分别与H2反应;硫化钠和氯气反应.
点评 本题考查位置、结构性质的关系及应用,为高频考点,涉及元素周期表与元素周期律的理解及应用,题目难度中等,注意把握金属性、非金属性比较.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年诺贝尔生理学或医学奖授予我国女药学家屠呦呦,她从中药中分离出青蒿素应用于疟疾治疗.青蒿素的键-线结构简式如图.下列关于青蒿素的说法不正确的是( )
2015年诺贝尔生理学或医学奖授予我国女药学家屠呦呦,她从中药中分离出青蒿素应用于疟疾治疗.青蒿素的键-线结构简式如图.下列关于青蒿素的说法不正确的是( )| A. | 分子式为C15H22O5 | B. | 属于芳香族化合物 | ||
| C. | 可发生水解反应 | D. | 含有过氧键(-O-O-)有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 容量瓶、分液漏斗和滴定管都需要验漏 | |
| B. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| C. | 用装置乙加热分解NaHCO3固体 | |
| D. | 配制500mL0.1mol•L?1NaCl溶液用到的玻璃仪器只有500mL容量瓶、烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.12mol | B. | 0.2mol | C. | 0.4mol | D. | 0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,23g NO2和N2O4的混合气体含有NA个氧原子 | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA | |
| D. | 1molFe与1molCl2充分反应,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量铜粉后,搅拌、可过滤可除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 通过装有NaOH溶液的确洗气瓶来除去CO2中混有的HCl气体 | |
| C. | 某无色未知溶液中加入BaCl2溶液,有白色沉淀,可推断溶液中的一定含有SO42- | |
| D. | 未知溶液中加入盐酸产生使澄清石灰水变浑浊的气体,则溶液中一定大量含CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) $?_{500℃/30MPa}^{催化剂}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 含 1mol NaOH的稀溶液分别和含1mol CH3COOH、1mol HNO3的稀溶液反应,后者比前者放出的热量多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com