
| A. | 电解质 | B. | 氧化剂 | C. | 还原剂 | D. | 胶体 |
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 | |
| B. | 平衡时,其他条件不变,增加 NH3 的浓度,废气中氮氧化物的转化率减小 | |
| C. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 | |
| D. | 单位时间内消耗 NO 和 N2 的物质的量比为 1:2 时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol羟基与1 mol氢氧根离子所含的电子数均为9NA | |
| B. | 常温下,44 g N2O和CO2组成的混合气体,所含原子数为3NA | |
| C. | 0.1 mol/L的NaClO溶液,含有的阴离子数为0.1NA | |
| D. | 常温下,将 1 mol Fe投入过量浓硝酸中,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、Cu2+、NO3-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Na+、Ca2+、Cl-、CO32- | D. | K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64 g | B. | 64 | C. | 64 g•mol-1 | D. | 32 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在托盘天平的两个托盘上各放一张大小一样的纸,然后将NaOH固体放在纸上进行称量 | |
| B. | 把称量的NaOH固体放入盛有适量蒸馏水的烧杯中,溶解后立即把溶液转移到容量瓶中 | |
| C. | 用蒸馏水洗涤烧杯、玻璃棒2~3次,每次洗涤后的溶液都注入容量瓶中 | |
| D. | 沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹液面恰好与刻度相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
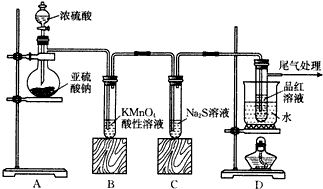
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com