
 25℃时某些弱酸的电离平衡常数如表所示:
25℃时某些弱酸的电离平衡常数如表所示:| CH3COOH | HClO | H2CO3 |
| K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
| A. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
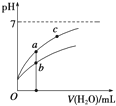
| B. | 图象中a、c两点所处的溶液中$\frac{c({P}^{-})}{c(HP).c(O{H}^{-})}$相等(HP代表CH3COOH或HClO) | |
| C. | 图象中a点酸的浓度大于b点酸的浓度 | |
| D. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO${\;}_{3}^{2-}$ |
分析 A.酸的电离常数越大,则酸根离子的水解程度越小;
B.$\frac{c({P}^{-})}{c(HP).c(O{H}^{-})}$的分子、分母同时乘以氢离子浓度可得:$\frac{K(HP)}{{K}_{w}}$,温度不变,则该比值不变;
C.先根据电离程度大小判断醋酸、次氯酸对应曲线及起始浓度大小,a、b两点加入水的体积相同,则此时酸溶液浓度取决于酸的起始浓度;
D.根据强酸制取弱酸判断,反应生成的应该为碳酸氢根离子.
解答 解:A.醋酸的电离常数大于次氯酸,所以醋酸的水解程度小于次氯酸,醋酸钠和次氯酸钠都是强碱弱酸盐,其混合溶液呈碱性,所以相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故A错误;
B.在$\frac{c({P}^{-})}{c(HP).c(O{H}^{-})}$的分子、分母上同时乘以c(H+)可得:$\frac{K(HP)}{{K}_{w}}$,由于水的离子积和电离平衡常数只受温度影响,a、c的温度相同,则该比值相等,故B正确;
C.pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以a所在曲线表示CH3COOH,b所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度减小,次氯酸的浓度较大,a、b两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图象中a点酸的浓度小于b点酸的浓度,故C错误;
D.碳酸的二级电离小于次氯酸,所以碳酸氢根离子的酸性小于次氯酸,则向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O═HClO+HCO3-,故D错误;
故选B.
点评 本题考查电解质的强弱与电离常数的关系,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,明确酸的电离常数与酸的强弱、酸根离子水解能力的关系是解本题关键.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④ | C. | ②③④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热饱和三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ | |
| B. | 磷酸二氢根电离的离子方程式:H2PO4-+H2O?H3O++HPO42- | |
| C. | 少量碳酸氢钙溶液与氢氧化钠溶液混合的离子方程式Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| D. | 在0.5mol•L-1的K2Cr2O7溶液中存在如下平衡:CrO72-+H2O?2CrO42-+2H+,其平衡常数K的表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 126C、136C、146C为碳元素的三种核素.元素周期表中碳的相对原子质量为12.01,说明自然界中的碳主要以126C的核素形式存在 | |
| B. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,加快该反应的速率,却不能提高该反应的平衡转化率 | |
| C. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,某物质的热值越高则其标准燃烧热越大 | |
| D. | 绿色荧光蛋白在研究癌症发病机制的过程中应用突出,但其在酸性或碱性条件下可能会失去发光功能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:丙>丁>乙 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 乙、丙、丁的最高价氧化物对应的水化物能相互反应 | |
| D. | 甲、乙、丙的氧化物均只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验步骤 | 实验用品 | |
| A | 步骤1:将海带灼烧灰化 |  |
| B | 步骤2:将海带灰溶解、过滤 |  |
| C | 步骤3:氧化滤液中的I- |  |
| D | 步骤4:检验碘元素 |  |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y |
| A | NH3 | CO2 |
| B | Cl2 | CO2 |
| C | SO2 | NO2 |
| D | Cl2 | SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到的是红褐色沉淀 | |
| B. | 该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4 | |
| C. | 向该溶液中加入适量氯水,调节pH到4~5后过滤,可获得纯净的CuSO4溶液 | |
| D. | 向该溶液中加入适量氨水,调节pH到9.6后过滤,将所得沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com