
【题目】请应用化学反应原理的相关知识解决下列问题:
![]() 已知NaCl的溶解热为
已知NaCl的溶解热为![]() 吸热
吸热![]()
![]()
![]()
![]()
![]()
写出钠在氯气中燃烧的热化学方程式:__________。
![]() 一定条件下,在
一定条件下,在![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 发生反应:
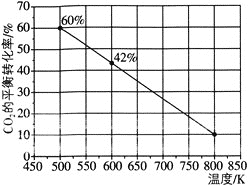
发生反应:![]() ,如图所示为反应体系中
,如图所示为反应体系中![]() 的平衡转化率与温度的关系曲线。已知在温度为
的平衡转化率与温度的关系曲线。已知在温度为![]() 的条件下,该反应
的条件下,该反应![]() 达到平衡状态;
达到平衡状态;
![]() 该反应是________
该反应是________![]() 填“吸热”或“放热”
填“吸热”或“放热”![]() 反应。
反应。
![]() 在
在![]() 时段反应速率
时段反应速率![]() 为_________。
为_________。
![]() 若改充入
若改充入![]() 和
和![]() ,图中的曲线会_________
,图中的曲线会_________![]() 填“
填“![]() 。
。
![]() 根据下表数据回答问题:
根据下表数据回答问题:
表1 ![]() 时浓度为
时浓度为![]() 两种溶液的pH
两种溶液的pH
溶质 | NaClO |
|
pH |
|
|
表2 ![]() 时两种酸的电离平衡常数
时两种酸的电离平衡常数
|
| |
|
|
|
|
|
|
![]() 根据表1能不能判断出
根据表1能不能判断出![]() 与HClO酸性强弱?_____________
与HClO酸性强弱?_____________![]() 填“能”或“不能”
填“能”或“不能”![]() 。
。
![]() 溶液中离子浓度由大到小的顺序为__________。
溶液中离子浓度由大到小的顺序为__________。
![]() 溶液和
溶液和![]() 溶液反应的离子方程式为________。
溶液反应的离子方程式为________。
![]() 已知:
已知:![]() 时,
时,![]() 、
、![]() ;AgCl为白色沉淀,
;AgCl为白色沉淀,![]() 为砖红色沉淀。
为砖红色沉淀。![]() 时,向
时,向![]() 和
和![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 溶液至过量且不断搅拌,实验现象为__________。
溶液至过量且不断搅拌,实验现象为__________。
【答案】![]()
![]() 放热
放热 ![]() 下移 不能
下移 不能 ![]()
![]() 先生成白色沉淀,后生成砖红色沉淀
先生成白色沉淀,后生成砖红色沉淀
【解析】
(1)根据盖斯定律计算所求反应的焓变;
(2)①根据图象分析,随着温度升高,CO2平衡转化率降低,表明温度升高不利于反应正向进行;
②根据速率v=![]() 结合三段式进行计算;
结合三段式进行计算;
③改充入2mol CO2和3mol H2,相当于增加了CO2的比例,可使H2的转化率上升,自身转化率下降;
(3)①根据NaClO和Na2CO3的pH值只能比较HClO和HCO3-的酸性强弱;
②0.1mol/L Na2SO3溶液中,SO32-水解使溶液显碱性,根据溶液中存在的化学平衡比较溶液中各离子的相对浓度大小;
③根据电离常数分析,H2SO3的酸性比H2CO3的酸性强,因此SO2通入NaHCO3溶液中生成CO2,据此写出反应的离子方程式;
(4)Cl-和CrO42-浓度均为0.1mol/L的混合溶液中逐滴加入AgNO3溶液,Cl-和CrO42-沉淀时最小的c(Ag+),进而得到那种离子先沉淀。
![]() 由NaCl的溶解热可知:
由NaCl的溶解热可知:![]()
![]() ,
,![]()
![]() ,
,![]()
![]() ,Na在
,Na在![]() 中燃烧的化学方程式为
中燃烧的化学方程式为![]() ,该反应可由
,该反应可由![]() 得到,根据盖斯定律可求算出该反应的反应热:
得到,根据盖斯定律可求算出该反应的反应热:![]() 。
。
![]() 由图像可知其他条件不变时,温度越高,
由图像可知其他条件不变时,温度越高,![]() 平衡转化率越低,即升高温度,平衡逆向移动,逆反应为吸热反应,所以正反应是放热反应。
平衡转化率越低,即升高温度,平衡逆向移动,逆反应为吸热反应,所以正反应是放热反应。![]() 由图像可知反应在
由图像可知反应在![]() 达到平衡状态时
达到平衡状态时![]() 的平衡转化率为
的平衡转化率为![]() ,所以
,所以![]() 时段
时段 。
。![]() 充入
充入![]() 和
和![]() 可认为是先充入
可认为是先充入![]() 和
和![]() ,则得到的曲线如题图,在该平衡的基础上再充入
,则得到的曲线如题图,在该平衡的基础上再充入![]() ,尽管平衡会正向移动,但是
,尽管平衡会正向移动,但是![]() 的平衡转化率会降低,即图中曲线会下移。
的平衡转化率会降低,即图中曲线会下移。
![]() 对应HClO,
对应HClO,![]() 对应
对应![]() ,所以不能比较HClO与
,所以不能比较HClO与![]() 酸性的强弱。
酸性的强弱。![]() 、
、![]() 、
、![]() ,由于水解是微弱的,且水解程度逐渐减小,则溶液中各离子浓度大小关系为
,由于水解是微弱的,且水解程度逐渐减小,则溶液中各离子浓度大小关系为![]() 。
。![]() SO
SO![]() 的一级电离平衡常数为
的一级电离平衡常数为![]() ,二级电离平衡常数为
,二级电离平衡常数为![]() ,H
,H![]() CO
CO![]() 的一级电离平衡常数为
的一级电离平衡常数为![]() ,酸性:
,酸性:![]() ,故H
,故H![]() SO
SO![]() 溶液与NaHCO
溶液与NaHCO![]() 溶液反应只能生成
溶液反应只能生成![]() ,不会生成
,不会生成![]() ,反应的离子方程式为
,反应的离子方程式为![]() 。
。
![]() ,
,![]() 时,当
时,当![]() 刚好生成AgCl时,
刚好生成AgCl时,![]() ,
,![]() ,当
,当![]() 刚好生成
刚好生成![]() 时,
时,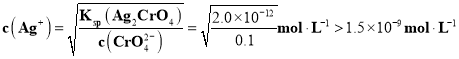 ,所以先生成白色的AgCl沉淀,然后再生成砖红色的
,所以先生成白色的AgCl沉淀,然后再生成砖红色的![]() 沉淀。
沉淀。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】三种常见单萜类化合物的结构如下图所示。下列说法正确的是( )
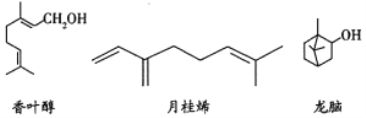
A. 香叶醇和龙脑互为同分异构体,分子式均为![]()
B. 可用金属钠鉴别香叶醇和月桂烯
C. 龙脑分子中所有碳原子在同一个平面上
D. 1mol月桂烯最多能与![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
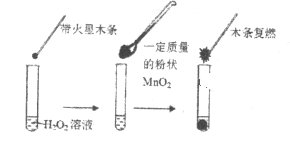
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂。该实验________(填“能”或“不能”)达到目的,原因是___________。
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1%H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积 | 49 | 61 | 86 |
由此得出的结论是______________。
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有![]() )
)
试管 | I | II | III |
滴加试剂 | 5滴 | 5滴 | 5滴 0.3 |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是___________,实验III的目的是___________。
(4)查阅资料得知:将作为催化剂的![]() 溶液加入
溶液加入![]() 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中![]() 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是_________________和_________________(按反应发生的顺序写)。
均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是_________________和_________________(按反应发生的顺序写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述正确的是( )
A.分子组成是C5H10O2属于羧酸的同分异构体有5种
B.菲的结构简式为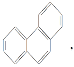 其一硝基取代物有10种
其一硝基取代物有10种
C.C3H8的二氯取代物最多有3种
D.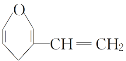 和
和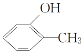 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是

A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用。CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) ![]() CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
物质 | CO | H2 | CH3OH |
浓度/(mol·L-1) | 0.9 | 1.0 | 0.6 |
(1)反应达到平衡时,CO的转化率为________。
(2)该反应的平衡常数K=________。
(3)恒温恒容条件下,可以说明反应已达到平衡状态的是________(填字母)。
A.v正(CO)=2v逆(H2)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(4)若将容器体积压缩到1 L,则达到新平衡时c(H2)的取值范围是__________。
(5)若保持容器体积不变,再充入0.6 mol CO和0.4 mol CH3OH,此时v正__v逆(填“>”“<”或“=”),平衡_____________移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
I (pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
II(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
IV(pH=4,含 Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是( )
A.由于Cu2+存在,IV中M的分解速率比I快
B.其它条件相同时,水样酸性越强,M的分解速率越快
C.在0~25 min内,Ⅲ中M的分解百分率比II
D.在0~20 min内,I中M的平均分解速率为0.015mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com