
【题目】pH是溶液中c(H+)的负对数,若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,某浓度的草酸(H2C2O4)水溶液中pC(H2C2O4),pC(HC2O4-)、pC(C2O42-)随着溶液pH的变化曲线如图所示:下列说法不正确的是
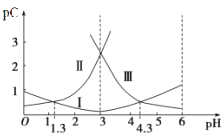
A. 曲线I代表HC2O4-的浓度随着pH增大先变小后变大
B. 草酸的电离常数 Kal=l×10-1.3; Ka2= l×10-4.3
C. pH=4时,c(HC2O4-)>c(C2O42-)>c(H2C2O4)
D. 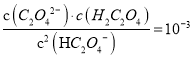
【答案】A
【解析】A、曲线I代表HC2O4-的浓度随着pH增大先变大后变小,PC越大,HC2O4-的浓度越小,故A错误;B、图中两点c(HC2O4-)=c(H2C2O4)=c(C2O42―),草酸的电离常数Kal=c(HC2O4-)c(H+ )/c(H2C2O4)=c(H+ )=l×10-1.3,同理Ka2=c(C2O42―)c(H+ )/c(HC2O4― )=c(H+ )= l×10-4.3,故B正确;C、pH=4时,作垂线交三条曲线,得三个点,Pc(HC2O4-)<Pc(C2O42-)<Pc(H2C2O4),故c(HC2O4-)>c(C2O42-)>c(H2C2O4),故C正确;D、 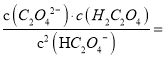
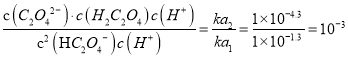 ,故D正确;故选D。
,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
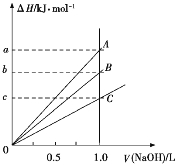
A.A表示稀硝酸与NaOH溶液的反应
B.B表示稀醋酸与NaOH溶液的反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3kJ。
(2)甲烷与CO2可用于合成水煤气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1gCH4完全反应可释放15.46kJ的热量,则:
①能表示该反应过程中能量变化的是________(填字母)。

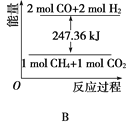

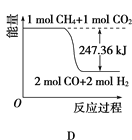
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为________。

(3)C(s)与H2 (g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH=_____。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_______(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成水煤气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S与CO2在高温下发生反应:H2S(g)+CO2(g) ![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)。
A. H2S B. CO2 C.COS D.N2
②在620 K重复实验,平衡后水的物质的量分数为0.03,该反应的ΔH________0(填“>”“<”或“=”)。
③H2S的平衡转化率α1=_____%,反应平衡常数K=______。(第③小题要写计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A、B、C分别是三种有机物的结构模型:

请回答下列问题:
(1)A、B两种模型分别是有机物的______模型和_____模型.
(2)C及其同系物的分子式符合通式__________(用n表示),有机物C具有的结构或性质是______(填字母).
a.是碳碳双键和碳碳单键交替的结构 b.有毒、不溶于水、密度比水小
c.能使酸性KMnO4溶液和溴水褪色 d.一定条件下能与氢气或氧气反应
(3)分子性质是由分子的结构决定的,通过对下图分子结构的观察来推测它的性质:![]() ,此有机物中含有的官能团______(填名称),苯基部分可发生____反应和_____反应(填反应类型)
,此有机物中含有的官能团______(填名称),苯基部分可发生____反应和_____反应(填反应类型)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯和其他无机原料合成环状酯E和髙分子化合物H的示意图如图所示:

请回答下列问题:
(1)写出以下物质的结构简式:B______,G_______
(2)写出以下反应的反应类型:X_____,Y______.
(3)写出以下反应的化学方程式:A→B:_______
(4)若环状酯E与NaOH水溶液共热,则发生反应的化学方程式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“银-Ferrozine”法测室内甲醛含量的原理为:
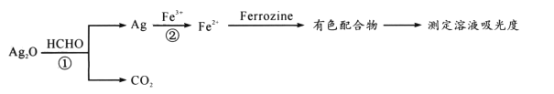
已知:吸光度与溶液中有色物质的浓度成正比
下列说法正确的是
A. 反应①中参与反应的HCHO为30g时转移电子2mol
B. 可用双氧水检验反应②后的溶液中是否存在Fe3+
C. 生成44.8 LCO2时反应②中参加反应的Ag一定为8mol
D. 理论上测得溶液吸光度越高,HCHO含量也越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置,使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
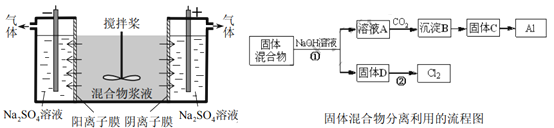
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________。B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化,加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl的浓度 c.溶液的酸度
Ⅱ.含铬元素溶液的分离和利用
(3)用惰性电极电解时,![]() 能从浆液中分离出来的原因是__________;阴极室生成的物质为___________(写化学式)。
能从浆液中分离出来的原因是__________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com