
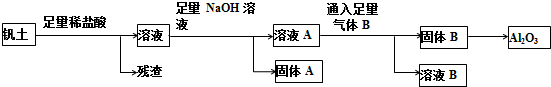
分析 钒土主要成分是Al2O3,还有SiO2、Fe2O3、FeCO3、MgCO3等杂质,除SiO2不反应外,与盐酸反应生成的金属阳离子有Al3+、Fe3+、Fe2+、Mg2+等,这些金属阳离子再与足量氢氧化钠反应后生成的可溶物为NaAlO2,不溶物固体A为Fe(OH)2、Fe(OH)3、Mg(OH)2,溶液A为NaAlO2溶液和氢氧化钠溶液的混合物,溶液中通入足量B为二氧化碳气体,二氧化碳和氢氧化钠反应生成碳酸氢钠,二氧化碳和偏氯酸钠溶液反应生成氢氧化铝和碳酸氢钠,过滤得到固体B为氢氧化铝,溶液B为碳酸氢钠溶液,固体B受热分解生成氧化铝,
(1)矾土与稀盐酸反应生成金属阳离子后,再和氢氧化钠反应生成的沉淀就是固体A为Fe(OH)2、Fe(OH)3、Mg(OH)2;
(2)溶液A的溶质就是矾土与稀盐酸反应生成金属阳离子铝离子后,再和氢氧化钠反应生成的可溶性物质溶液A中含有AlO2-;
(3)电解时阳极上氧离子失电子生成氧气,氧气在高温时会氧化碳块,使碳块消耗;
(4)AlCl3是共价化合物,在熔融状态下不能电离出离子,不导电,不能用来电解;
(5)根据Al元素质量守恒,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,结合定量关系Al~AlO2-~HCO3-计算碳酸氢钠质量.
解答 解:(1)钒土主要成分是Al2O3,还有SiO2、Fe2O3、FeCO3、MgCO3等杂质,除SiO2不反应外,与盐酸反应生成的金属阳离子有Al3+、Fe3+、Fe2+、Mg2+等,这些金属阳离子再与足量氢氧化钠反应后生成的溶液A为NaAlO2溶液和氢氧化钠溶液的混合溶液,不溶物固体A为Fe(OH)2、Fe(OH)3、Mg(OH)2,
故答案为:Fe(OH)2、Fe(OH)3、Mg(OH)2;
(2)由分析可知溶液A主要为NaAlO2溶液和剩余的氢氧化钠溶液,通入二氧化碳气体首先和氢氧化钠反应生成碳酸氢钠,反应的离子方程式为:CO2+OH-═HCO3-,二氧化碳和NaAlO2溶液反应生成氢氧化铝程度和碳酸氢钠溶液,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:CO2+OH-═HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)电解时阳极上氧离子失电子生成氧气,氧气在高温条件下会氧化碳块,使碳块消耗,所以需要定期补充阳极碳块,
故答案为:电解冶炼铝的阳极产物为O2,在高温条件下,O2与阳极碳发生反应消耗阳极碳块;
(4)AlCl3是共价化合物,受热时AlCl3易升华,在熔融状态下不导电,不能用来电解,工业上是利用氧化铝为离子化合物,在熔融状态下可导电,可以用来电解制备铝,
故答案为:不可行;AlCl3是共价化合物,受热时AlCl3易升华,熔融状态的AlCl3不导电;
(5)根据Al元素质量守恒,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,结合定量关系Al~AlO2-~HCO3-计算,
每生产10.0t金属铝,理论上可得到小苏打产品的质量最少为x,
Al~AlO2-~NaHCO3,
27 84
10.0t x
x=31.1t
故答案为:最少31.1;
点评 本题为生产工艺流程题,涉及电解、计算等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息.题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.44s | B. | 1s | C. | 7.33s | D. | 2s |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 78g由Na2S和Na2O2组成的固体混合物,含有的阴离子数为NA | |
| B. | 标准状况下,22.4L CCl4中含有的分子数为NA | |
| C. | 将1mol FeCl3水解制成胶体,所得胶体中含有的胶体粒子数NA | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | 用石墨作电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 向NH4HCO3溶液中滴加过量Ba(OH)2溶液:HCO3-+OH-+Ba2+═H2O+BaCO3↓ | |
| D. | NaAlO2溶液中通入过量二氧化碳:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com