
| A. | 32克O2所含的原子数目为2NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 1molH2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是1mol |
分析 A、氧气由氧原子构成;
B、水为三原子分子;
C、分子个数N=nNA;
D、物质的量n=$\frac{N}{{N}_{A}}$.
解答 解:A、氧气由氧原子构成,故32g氧气中含有的氧原子的物质的量为2mol,个数为2NA个,故A正确;
B、水为三原子分子,故0.5mol水中含1.5NA个原子,故B正确;
C、分子个数N=nNA=1mol×NA/mol=NA个,故C正确;
D、物质的量n=$\frac{N}{{N}_{A}}$=$\frac{0.5{N}_{A}}{{N}_{A}/mol}$=0.5mol,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:实验题
 苯甲酸乙酯(C9H10O2)有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,其制备步骤如下:
苯甲酸乙酯(C9H10O2)有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,其制备步骤如下: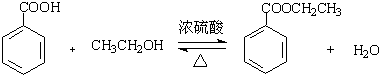 .
.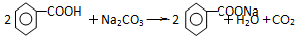 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
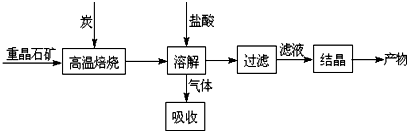
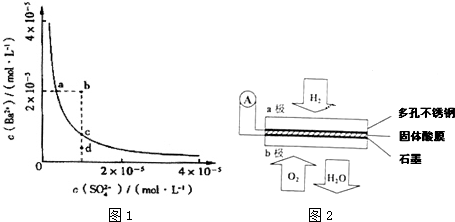
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小容器体积,平衡向右移动 | |
| B. | 加入催化剂,平衡不移动故正逆反应速率不变 | |
| C. | 增大c(X),X的转化率增大 | |
| D. | 降低温度,Y的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使PH=0的溶液:Fe2+、NO3-、SO42-、I- | |
| B. | C(H+)=10-14mol•L-1的溶液中:Na+、AlO2-、S2-、SO32- | |
| C. | 酸性环境下:Na+、Cu2+、NO3-、SO42- | |
| D. | 使紫色石蕊试液变红的溶液中:K+、Na+、Ca2+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O的摩尔质量是18g | B. | 1mol氧的质量是16g | ||
| C. | 氧气的摩尔质量是32g•mol-1 | D. | 2molH2的摩尔质量是4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.请回答下列问题.
某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com