
| Ũ��/mol•L-1 ʱ��/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 35 | 0.32 | 0.34 | 0.15 |
���� C��s��+2NO��g��?N2��g��+CO2��g��
��ʼ��mol/L�� 1 0 0
ת����mol/L�� 0.6 0.3 0.3
ƽ�⣨mol/L�� 0.4 0.3 0.3
��1������v=$\frac{��c}{��t}$�����0��10min��V��NO����ʾ��ƽ����Ӧ���ʣ�
��2��ƽ��ʱNO���ĵ����ʵ���Ϊ��1.00mol-0.40mol=0.60mol���ݴ˼����NO��ת���ʣ�
��3������ƽ��ʱ�����Ũ�ȼ�ƽ�ⳣ���ı���ʽK=$\frac{c��{N}_{2}��•c��C{O}_{2}��}{c��NO��^{2}}$���㣻
��4��30��35min������Ũ������NO�Ͷ�����̼��Ũ�ȼ�С����ƽ�������ƶ����ݴ��жϸı��������
��� �⣺C��s��+2NO��g��?N2��g��+CO2��g��
��ʼ��mol/L�� 1 0 0
ת����mol/L�� 0.6 0.3 0.3
ƽ�⣨mol/L�� 0.4 0.3 0.3
��1��0��10min��V��NO����ʾ��ƽ����Ӧ����Ϊ��$\frac{��1-0.58��mol/L}{10min}$=0.042mol/��L•min����
�ʴ�Ϊ��0.042mol/��L•min����
��2��ƽ��ʱNO���ĵ����ʵ���Ϊ��1.00mol/L-0.40mol/L=0.60mol/L����ƽ��ʱNO��ת����Ϊ��$\frac{0.60mol/L}{1.00mol/L}$��100%=60%��
�ʴ�Ϊ��60%��
��3��T��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ��K=$\frac{c��{N}_{2}��•c��C{O}_{2}��}{c��NO��^{2}}$=$\frac{0.3��0.3}{��0.4��^{2}}$=0.56��
�ʴ�Ϊ��0.56��
��4���ɱ������ݿ�֪30��35min������Ũ������NO�Ͷ�����̼��Ũ�ȼ�С����ƽ�������ƶ���˵���ı��ʵ�������Ƿ����CO2��
�ʴ�Ϊ�������CO2��
���� ���⿼���˻�ѧƽ��ļ��㣬��Ŀ�Ѷ��еȣ��漰��ѧ��Ӧ���ʡ���ѧƽ�ⳣ����ת���ʵļ��㣬��ȷ��ѧƽ�⼰��Ӱ������Ϊ���ؼ���ע�����ջ�ѧ��Ӧ���ʡ���ѧƽ�ⳣ���ı���ʽ������������ѧ���Ļ�ѧ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
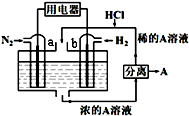 ��N2��H2Ϊ��Ӧ�����A��ϡ����Ϊ�������Һ�����Ƴ��̵ܹ�������ȼ�ϵ�أ�ԭ����ͼ��ʾ������˵������ȷ���ǣ�������
��N2��H2Ϊ��Ӧ�����A��ϡ����Ϊ�������Һ�����Ƴ��̵ܹ�������ȼ�ϵ�أ�ԭ����ͼ��ʾ������˵������ȷ���ǣ�������| A�� | b�缫Ϊ����������������Ӧ | |
| B�� | a�缫�����ķ�ӦΪN2+8H++6e-=2NH4+ | |
| C�� | A��Һ����������ΪNH4Cl | |
| D�� | ����Ӧ����1molN2ʱ�������ĵ�H2Ϊ67.2L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ�� �����Һ | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| ����CuSO4��Һ/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ܵ���ʵ�KspԽС���ܽ�Ⱦ�һ��ԽС | |
| B�� | ��AgCl����������Һ�м���NaCl������Һ��AgCl���ܽ�ȱ�С���ܶȻ�������С | |
| C�� | �ñ���Na2CO3��Һ���Խ�BaSO4ת��ΪBaCO3��˵��Ksp��BaCO3��С��Ksp��BaSO4�� | |
| D�� | һ����Ϊ��������Ũ��С��1.0��10-5 mol/Lʱ�����Ӿ��ѳ�����ȫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | IA | ��A | ��A | ��A | VA | VIA | V��A | 0 |
| 2 | �� | �� | ||||||
| 3 | �� | �� | �� | �� | �� | �� | ||
| 4 | �� | �� |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
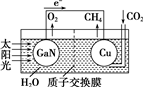 ��ѧ���õ����ز�����ͭ��װ����ͼ���˹����ϵͳ��ʵ������CO2��H2OΪԭ�Ϻϳ�CH4�������й�˵������ȷ���ǣ�������
��ѧ���õ����ز�����ͭ��װ����ͼ���˹����ϵͳ��ʵ������CO2��H2OΪԭ�Ϻϳ�CH4�������й�˵������ȷ���ǣ�������| A�� | ��װ���ǽ���ѧ��ת��Ϊ���� | |
| B�� | �����ص缫������ | |
| C�� | ͭ�缫����ĵ缫��ӦʽΪCO2+8e-+8H+�TCH4+2H2O | |
| D�� | ������������װ�õĵ��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
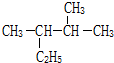 ��ϵͳ����Ϊ2��3-�������飮
��ϵͳ����Ϊ2��3-�������飮�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com