
【题目】NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.1L 0.1mol/L的氨水中有0.1NA个NH4+
B.17 g H2O2中含有8NA个电子
C.7.8g Na2S和7.8g Na2O2所含离子数相等,均为0.3 NA
D.标准状况下,22.4LNO与11.2LO2混合后气体的分子数为NA
【答案】C
【解析】解:A、一水合氨为弱碱,在溶液中部分电离,故溶液中的铵根离子的个数小于0.1NA个,故A错误; B、17g双氧水的物质的量n= ![]() =0.5mol,而双氧水中含18个电子,故0.5mol双氧水中含9NA个电子,故B错误;
=0.5mol,而双氧水中含18个电子,故0.5mol双氧水中含9NA个电子,故B错误;
C、Na2S和Na2O2的摩尔质量均为78g/mol,故7.8g Na2S和7.8g Na2O2的物质的量均为0.1mol,而两者均由2个钠离子和1个阴离子构成,故0.1molNa2S和Na2O2中含有的离子个数均为0.3NA个,故C正确;
D、NO和氧气反应后生成的NO2中存在平衡:2NO2N2O4 , 导致分子个数减少,即少于NA个,故D错误.
故选C.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】室温下,用0.10mol/L的盐酸分别滴定20.00mL浓度均为0.10mol/L氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示。

下列说法不正确的是
A. Ⅱ表示的是滴定氨水的曲线,当V(HC1)=20mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B. 当pH=7时,滴定氨水消耗的V(HCl)<20 mL,且c(NH4+)=c(Cl-)
C. 滴定氢氧化钠溶液,V(HCl) >20 mL 时一定有: c(Cl-) >c(Na+) >c(H+) >c(OH-)
D. 当滴定氨水消耗V(HC1)=10 mL 时,有: 2[c(OH-)-c(H+)]=c(NH4+)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在制玻璃的原料中,再加入下列物质后,可制得各种不同用途的玻璃:
a.氧化亚铜(Cu2O) b.氧化钴(Co2O3)
c.氧化铅(PbO) d.硼砂(Na2B4O7·10H2O)
①制造化学仪器的玻璃需加入的物质是。
②制造光学仪器的玻璃需加入的物质是。
③制造蓝色玻璃需加入的物质是。
④制造红色玻璃需加入的物质是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S 是一种大气污染物,工业上采取多种方法减少它的排放。
(1)工业上可采取生物脱H2S 方法减少H2S 的排放。生物脱H2S 的原理为:H2S + Fe2(SO4)3= S↓+ 2FeSO4 + H2SO4 4FeSO4 +O2 +2H2SO4 ![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
试回答下列问题:
①硫杆菌存在时,FeSO4被氧化的速率是无菌时5.0×105倍,该菌的作用是_________。
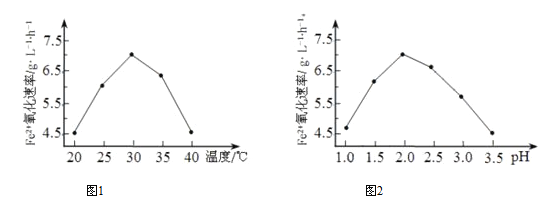
②由下图1和图2 判断使用硫杆菌的最佳条件为_________。若反应温度过高,反应速率下降,其原因是____________。
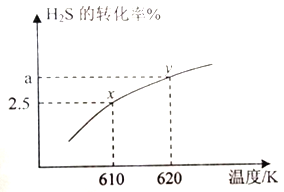
(2) 羰基硫(COS) 常在石化工业中用作在线仪表的校正气、标准气。其制备方法之一是H2S 与COS 在高温下发生反应: H2S(g)+CO2(g)![]() COS(g)+H2O(g) 在610K 时,将0.40mol H2S 与0.10molCO2充入2.5 L 的空钢瓶中,H2S的平衡转化率与温度的关系如图所示:
COS(g)+H2O(g) 在610K 时,将0.40mol H2S 与0.10molCO2充入2.5 L 的空钢瓶中,H2S的平衡转化率与温度的关系如图所示:
①下列说法能表明反应已达平衡状态的是__________。
A.H2S 和CO2的物质的量之比保持不变 B.混合气体的密度保持不变
C.混合气体的平均相对分子质量不再变化D.v逆(H2S)=V正(COS)
②该反应的△H______0.(填“>”“<”或“=”);x点对应温度下反应的平衡常数K=_____(保留两位有效数字)。
③在620K重复试验,若平衡后水的物质的量分数为0.030.则H2S 的转化率a=_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+浓度为0.4 mol/L,SO42-的浓度为0.7 mol/L,则该溶液中K+的浓度为( )
A. 0.1 mol/L B. 0.15 mol/L C. 0.2 mol/L D. 0.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列转化不属于煤或石油的综合利用的是( )
A.将煤干馏制得煤焦油和焦炭
B.在一定条件下将煤与氢气转化为液体燃料
C.将煤变为煤饼作燃料
D.将石油裂解制得乙烯等化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关海水综合利用的说法正确的是
A. 海水中含有钾元素,只需经过物理变化就可以得到钾单质
B. 海水蒸发制海盐的过程中只发生了化学变化
C. 从海水中可以得到NaCl,电解熔融NaCl可制备Na和Cl2
D. 利用潮汐发电是将化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K=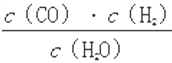 。请回答下列问题。
。请回答下列问题。
(1)若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
A.v正(H2O)=v逆(H2)
B.容器中气体的平均相对分子质量不随时间改变
C.消耗n mol H2的同时消耗n mol CO
D.容器中物质的总物质的量不随时间改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com