
【题目】某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡。经检验该过程产生两种气体,其中一种气体有刺激性气味。

(1)实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是_____________________
(2)请设计简单的实验方案检验上述实验中有刺激性气味的气体:__________________
(3)实验中0.2mol/L氯化铵溶液的pH为5.90,请用离子方程式解释原因:_________________
(4)该小组同学为探究镁与氯化铵溶液反应的原因设计了如下实验方案:
序号 | 实验试剂 | 实验现象 | |
实验1-1 | 0.20g镁粉 | 3.0mL 0.2mol/LNH4Cl溶液 | 反应明显,有气泡产生 |
实验1-2 | 0.20g镁粉 | 3.0mL盐酸 | 反应不明显,几乎没有气泡产生 |
①上述探究实验1-2选用的盐酸为_____________(填字母)。
A、1 mol·L-1 B、pH=1.0 C、0.2 mol·L-1 D、pH=5.90
②通过实验对比,说明NH4Cl 水解产生的H+ 对反应影响_____NH4+ 对反应影响(填“小于”、“大于”或“等于”)。
(5)该小组同学继续探究镁粉与氯化铵溶液反应剧烈的影响因素。
实验序号 | 实验试剂 | |
实验2-1 | 0.20g镁粉 | ________________ |
实验2-2 | 0.20g镁粉 | _________________ |
实验3-1 | 0.20g镁粉 | 3.0mL0.2mol/L NH4NO3溶液 |
实验3-2 | 0.20g镁粉 | 3.0mL0.2mol/L KNO3溶液 |
①实验2-1与实验2-2中实验现象说明Cl-对反应速率的影响很小,请补充完成实验方案所需的试剂。
②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,则两支试管中实验现象的不同之处是___________________
(6)写出镁与氯化铵溶液反应生成Mg2+的离子方程式_______________。
【答案】 因为气温低于25 ℃时,Kw小于1.0×10-14,纯水的pH略大于7 将湿润的红色石蕊试纸放在试管口看是否变蓝,如果变蓝,则有氨气生成,否则没有氨气生成(或者用蘸有浓盐酸的玻璃棒放在试管口,看是否有白烟生成,如果有白烟生成,则有氨气,否则没有氨气,答案合理即可) NH4++H2O![]() NH3·H2O+H+ D 小于 3.0 mL 0.2mol/LNaCl溶液 3.0 mL0.2mol/LNaNO3溶液 NH4NO3溶液(左试管)和KNO3溶液(右试管)分别与Mg粉反应,左试管反应剧烈,有大量气泡生成,右试管反应很少,没有气泡生成。 Mg + 2 NH4+ = Mg2 + + 2NH3 ↑+ H2 ↑
NH3·H2O+H+ D 小于 3.0 mL 0.2mol/LNaCl溶液 3.0 mL0.2mol/LNaNO3溶液 NH4NO3溶液(左试管)和KNO3溶液(右试管)分别与Mg粉反应,左试管反应剧烈,有大量气泡生成,右试管反应很少,没有气泡生成。 Mg + 2 NH4+ = Mg2 + + 2NH3 ↑+ H2 ↑
【解析】(1)水的电离是吸热过程,温度升高,促进水电离,PH变小,现PH约为7.3,因为气温低于25 ℃时,Kw小于1.0×10-14,纯水的pH略大于7 ;(2)检验实验中有刺激性气味的气体,根据元素守恒,应是NH3,将湿润的红色石蕊试纸放在试管口看是否变蓝,如果变蓝,则有氨气生成,否则没有氨气生成(或者用蘸有浓盐酸的玻璃棒放在试管口,看是否有白烟生成,如果有白烟生成,则有氨气,否则没有氨气,答案合理即可) ;(3)实验中0.2mol/L氯化铵溶液的pH为5.90,本质上是NH4+ 的水解,离子方程式为NH4++H2O![]() NH3·H2O+H+;(4)①对比实验是科学研究常用的一种实验方法,目的是通过比较实验的变量,找到想要研究的因素对实验结果的影响,从而为科学的研究提供事实依据和直接证据,设计时应控制其它变量相同,让一种条件发生变化,实验中0.2mol/L氯化铵溶液的pH为5.90,所以盐酸的pH也定为5.90比较合适,故选D;②通过实验对比,pH=5.90的盐酸,反应不明显,几乎没有气泡产生,说明NH4Cl 水解产生的H+ 对反应影响小于 NH4+ 对反应影响;(5)①实验2-1与实验2-2中实验现象说明Cl-对反应速率的影响很小,实验2-1可选用3.0 mL 0.2mol/LNaCl溶液,实验2-2可选用3.0 mL0.2mol/LNaNO3溶液 ,排除Cl― 的影响;②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,现象不同,NH4NO3溶液(左试管)和KNO3溶液(右试管)分别与Mg粉反应,左试管反应剧烈,有大量气泡生成,右试管反应很少,没有气泡生成。(6)镁与氯化铵溶液反应生成Mg2+的离子方程式 Mg + 2 NH4+ = Mg2 + + 2NH3 ↑+ H2 ↑。
NH3·H2O+H+;(4)①对比实验是科学研究常用的一种实验方法,目的是通过比较实验的变量,找到想要研究的因素对实验结果的影响,从而为科学的研究提供事实依据和直接证据,设计时应控制其它变量相同,让一种条件发生变化,实验中0.2mol/L氯化铵溶液的pH为5.90,所以盐酸的pH也定为5.90比较合适,故选D;②通过实验对比,pH=5.90的盐酸,反应不明显,几乎没有气泡产生,说明NH4Cl 水解产生的H+ 对反应影响小于 NH4+ 对反应影响;(5)①实验2-1与实验2-2中实验现象说明Cl-对反应速率的影响很小,实验2-1可选用3.0 mL 0.2mol/LNaCl溶液,实验2-2可选用3.0 mL0.2mol/LNaNO3溶液 ,排除Cl― 的影响;②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,现象不同,NH4NO3溶液(左试管)和KNO3溶液(右试管)分别与Mg粉反应,左试管反应剧烈,有大量气泡生成,右试管反应很少,没有气泡生成。(6)镁与氯化铵溶液反应生成Mg2+的离子方程式 Mg + 2 NH4+ = Mg2 + + 2NH3 ↑+ H2 ↑。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.HClO是弱酸,但NaClO强电解质
B.HCl,SO2、HBr三种气体都可用浓硫酸干燥
C.向浓氨水中滴加FeCl3饱和溶液,可制得Fe(OH)3胶体
D.SO2和SO3都是酸性氧化物,两者的水溶液都是二元强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。这里所用的“法”是指( )
A. 萃取 B. 渗析 C. 蒸馏 D. 升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
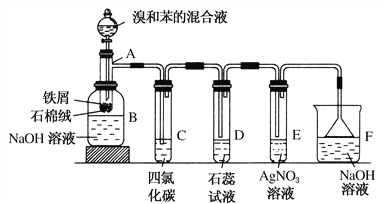
填写下列空白:
①试管A中的反应方程式为_____________________________________。
②试管C中四氯化碳的作用是:____________________________。反应开始后,观察D和E两试管,看到的现象为:________________________________。
写出E中反应的离子方程式__________________________________________。
③反应2~3 min后,在B中的NaOH溶液里可观察到的现象是___________。
④在上述整套装置中,具有防倒吸功能的仪器有________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述的方法不正确的是 ( )
A. 金属的电化学腐蚀比化学腐蚀更普遍
B. 用铝质铆钉铆接铁板,铁板易被腐蚀
C. 钢铁在干燥空气中不易被腐蚀
D. 用牺牲锌块的方法来保护船身
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理:

反应试剂、产物的物理常数:
名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
水 | 乙醇 | 乙醚 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:

实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。

(1)无色液体A的结构简式为 。操作Ⅱ为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是 。
(3)下列关于仪器的组装或者使用正确的是 。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入 ,分液,水层再加入 ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中与氮的固定无关的是
A.工业合成氨
B.工业上将氨转化成硝酸和其他氮的氧化物
C.豆科植物的根瘤菌吸收空气中的氮气使之转化成植物蛋白质
D.电闪雷鸣的雨天,N2与O2会反应并最终转化为硝酸盐被植物吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2与SO3(g)的反应类似于Na2O2与CO2(g)的反应,请写出Na2O2与SO3反应的化学方程式: . 每2molNa2O2参加反应,转移电子数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com