
���״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϣ����㷺�����л��ϳɡ�ҽҩ��ũҩ��Ϳ�ϡ�Ⱦ�ϡ����������ȹ�ҵ�С���ҵ��һ���ں����ܱ������в������з�Ӧ�ϳɼ״���
CO(g) 2H2(g)
2H2(g)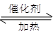 CH3OH(g)
CH3OH(g) Q
Q
�±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
 ����������Ҫ���COת���ʣ��ɲ�ȡ�Ĵ�ʩ
����������Ҫ���COת���ʣ��ɲ�ȡ�Ĵ�ʩ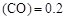 mol��L������CH3OH��ʾ�ķ�Ӧ����v
mol��L������CH3OH��ʾ�ķ�Ӧ����v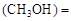 mol /(L��min)��
mol /(L��min)�� CO2(g)
CO2(g)  2CO(g) ƽ�ⳣ��K1
2CO(g) ƽ�ⳣ��K1 H2O(g)
H2O(g)  CO(g)
CO(g) H2(g) ƽ�ⳣ��K2
H2(g) ƽ�ⳣ��K2 H2O(g)
H2O(g)  H2(g)
H2(g) CO2(g) ƽ�ⳣ��K3
CO2(g) ƽ�ⳣ��K3
��1��BD (2��)
��2��>(1��)��C (1��)
��3��0.08 (1��) 80% (1��)
��4��K2=K1��K3 (2��)
�������������
��1��A�����ܱ�������������䣬�������壬�����غ㣬���������ܶ�ʼ�ղ��䣬������ƽ���־������B��ȷ��C����CH3OH������CO��������ͬ�����ʣ�����D��ȷ��
��2���ɱ���֪��T���ߣ�K��С������Ӧ�Ƿ��ȷ�Ӧ��Q>0�����COת���ʣ���Ӧ������У�ѡC��
��3�� CO(g) 2H2(g)
2H2(g)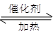 CH3OH(g)
CH3OH(g) Q
Q
��Ũ�ȣ� 1 3 0
��Ũ�� 0.8 1.6 0.8
ƽ�� 0.2
v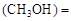 0.8/10=0.08(mol��L��min)
0.8/10=0.08(mol��L��min)
CO��ת����=" 0.8" /1*100%= 80%
��4����C(s) CO2(g)
CO2(g)  2CO(g) ƽ�ⳣ��K1
2CO(g) ƽ�ⳣ��K1
��C(s) H2O(g)
H2O(g)  CO(g)
CO(g) H2(g) ƽ�ⳣ��K2
H2(g) ƽ�ⳣ��K2
��CO(g) H2O(g)
H2O(g)  H2(g)
H2(g) CO2(g) ƽ�ⳣ��K3
CO2(g) ƽ�ⳣ��K3
��=��+�� ����K2=K1��K3
���㣺�����Ի�������Ϊ����������ƽ�ⳣ����ƽ������֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ�������£����淴ӦA2(g)+B2(g) 2C(g)��һ���ܱ������дﵽƽ��ʱ,���c(A2)=0��5mol��L-1��c(B2)=0��1mol��L-1��c(C)=1��6mol��L-1����
2C(g)��һ���ܱ������дﵽƽ��ʱ,���c(A2)=0��5mol��L-1��c(B2)=0��1mol��L-1��c(C)=1��6mol��L-1����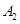 ��
��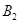 ��C����ʼŨ�ȷֱ�Ϊa mol��L-1��b mol��L-1��g mol��L-1��ȷ����
��C����ʼŨ�ȷֱ�Ϊa mol��L-1��b mol��L-1��g mol��L-1��ȷ����
(l)a��gӦ����Ĺ�ϵʽΪ_____________��
(2)����Ӧ������Ӧ����ʼ���У���g=_________,a�����ֵΪ__________��
(3)����Ӧ���淴Ӧ����ʼ���У���b=_________��a����СֵΪ_________��
(4)b��ȡֵ��ΧΪ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
I.��¯��������Ҫ��ӦΪFe2O3��3CO2Fe��3CO2��
��֪�÷�Ӧ��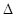 H����1000��ʱ��K=64����1000����������ݻ�10 L���ܱ������У�����Fe��Fe2O3��CO��CO2��1��OmoI����Ӧ��10 min��ﵽƽ�⡣
H����1000��ʱ��K=64����1000����������ݻ�10 L���ܱ������У�����Fe��Fe2O3��CO��CO2��1��OmoI����Ӧ��10 min��ﵽƽ�⡣
(1)��ʱ�䷶Χ�ڵ�ƽ����Ӧ����v(CO2��=_________mol/L min
min
(2) �����ת����_________________��
(3)�����CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_______________��
| A������Fe���� | B������Fe2O3���� |
| C�����߷�Ӧ�¶� | D���Ƴ�����CO2 |
 FeO��s��+CO��g������ƽ�ⳣ��ΪK1����ѧ��Ӧ�ڣ�Fe��s��+H2O��g��
FeO��s��+CO��g������ƽ�ⳣ��ΪK1����ѧ��Ӧ�ڣ�Fe��s��+H2O��g�� FeO��s��+H2��g������ƽ�ⳣ��K2�����¶�973K��1173K����£�K1��K2��ֵ�ֱ����£�
FeO��s��+H2��g������ƽ�ⳣ��K2�����¶�973K��1173K����£�K1��K2��ֵ�ֱ����£�| �¶� | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ��һֱ�����ڡ��˹��̵������·����о���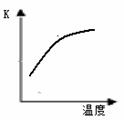
��1�����¡��˹��̵������о����������³�ѹ�����������£�N2�ڴ���������ˮ������Ӧ��2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g)+ Q����
4NH3 (g)+3O2 (g)+ Q����
��֪�÷�Ӧ��ƽ�ⳣ��K���¶ȵĹ�ϵ����ͼ����˷�Ӧ�� Q������ 0 (���������������)��
��2�������£����������Ӧ�����������ܱ������з���������Ӧ�ﵽƽ��ʱ�� (ѡ����)��
A�������������ƽ������������ʱ����仯 B��v��N2��/ v��O2��=2:3
C��������������ܶȲ���ʱ����仯 D��ͨ��ϡ����������߷�Ӧ������
��3������Ӧ���ɵĻ������ͨ��ˮ�м��ɵð�ˮ����ˮϡ��0��1mol��L-1��ˮ����Һ������ˮ�������Ӷ������������������������������ ������ĸ��ţ���
A��c(H+)��c(NH3��H2O)/c(OH��)��������B��c(NH4+)��c(OH��)/c(NH3��H2O)
C��c(H+)��c(OH��)������������ ��D��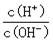
��4��������,�ں�ѹ�ܱ�������������Ӧ�ﵽƽ�����������������ʱ��ͨ��2mol N2,������ͼ�л�����(v��)����(v��)��Ӧ������ʱ��t�仯��ʾ��ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(14��)��ҵ���������Ҫ��Ӧ��4NH3(g)+5O2(g)  4NO(g)+6H2O(g)��H=-akJ/mol(a��0)
4NO(g)+6H2O(g)��H=-akJ/mol(a��0)
(1)�����4molNH3��5molO2���������У��ﵽƽ��ʱ���ų�����0.8akJ����Ӧʱת�Ƶĵ�����Ϊ
mol
(2)�������������䣬���й�ϵͼ�д������ ��ѡ����ţ�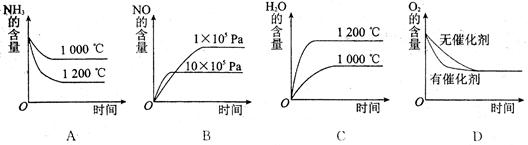
(3)t��ʱ�����ݻ��̶����ܱ������з���������Ӧ�������ڸ����ʵ�Ũ�����±�
| Ũ��(mol/L) ʱ��(min) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| �� ʼ | 4.0 | 5.5 | 0 | 0 |
| ��2min | 3.2 | x | 0.8 | 1.2 |
| ��4min | 2.0 | 3.0 | 2.0 | 3.0 |
| ��6min | 2.0 | 3.0 | 2.0 | 3.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ��һֱ�����ڡ��˹��̰������·����о���Ŀǰ�ϳɰ�����ԭ��Ϊ��N2(g) +3H2(g)  2NH3(g)+92.4 kJ/mol673K��30MPa�£������ϳɰ���Ӧ��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ��
2NH3(g)+92.4 kJ/mol673K��30MPa�£������ϳɰ���Ӧ��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ��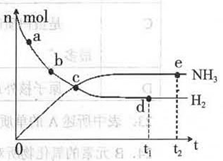
��1������������ȷ����
A����a������Ӧ���ʱȵ�b�Ĵ�
B����c����Ӧ�ﵽƽ��
C����d�͵�e����n (N2)��ͬ
D��773K��30MPa �£���Ӧ��t2ʱ�̴ﵽƽ�⣬��n(NH3)��ͼ��e���ֵ��
��2�����ݻ�Ϊ2.0 L���ݵ��ܱ������г���0.80 mol N2(g)��1.60 mol H2(g)��673K��30MPa�´ﵽƽ��ʱ��NH3���������Ϊ20%���������£�N2(g)+3H2(g)  2NH3(g)��ƽ�ⳣ��ֵΪ��___��
2NH3(g)��ƽ�ⳣ��ֵΪ��___��
��3��KֵԽ������Ӧ�ﵽƽ��ʱ( )��
A. H2��ת����һ��Խ�� B��NH3�IJ���һ��Խ��
C������Ӧ���е�Խ��ȫ D����ѧ��Ӧ����Խ��
��4��1998��ϣ������˹��´�ѧ����λ��ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+����ʵ���˸��¡���ѹ�¸�ת���ʵĵ��ϳɰ�����ʵ��װ����ͼ�������ĵ缫��ӦΪ��H2-2e��2H+���������ĵ缫��ӦΪ��_____________��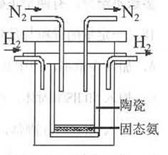
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ʵ�� �����ܼ��š� �͡���̼���á���һ����Ҫ���������ν�CO2ת��Ϊ�����õ���Դ��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���һ�������·�����Ӧ��
CO2(g)+3H2(g) CH3OH(g)+H2O(g)����ͼ1��ʾ�÷�Ӧ����������(��λΪkJ��mol-1)�ı仯��
CH3OH(g)+H2O(g)����ͼ1��ʾ�÷�Ӧ����������(��λΪkJ��mol-1)�ı仯��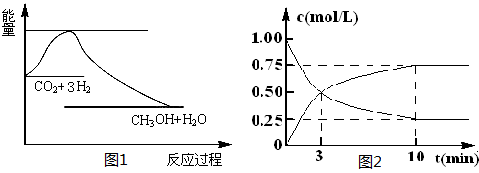
��1�����ڸ÷�Ӧ������˵���У���ȷ���� (����ĸ)��
A����H��0����S��0 B����H��0����S��0
C����H��0����S��0 D����H��0����S��0
��2��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊl L���ܱ������У�����l mol CO2��4mol H2��һ�������·�����Ӧ��CO2(g)+3H2(g) CH3OH(g)+H2O(g)�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ2��ʾ��
CH3OH(g)+H2O(g)�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ2��ʾ��
�ٴӷ�Ӧ��ʼ��ƽ�⣬CH3OH��ƽ����Ӧ����v(CH3OH) �� ��H2��ת����w(H2) = ��
�ڸ÷�Ӧ��ƽ�ⳣ������ʽK�� ��
�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ����� (����ĸ)��
A�������¶�
B����CH3OH(g)��ʱҺ�����
C��ѡ���Ч����
D���ٳ���l molCO2��4 molH2
��3��25�棬1.01��105Paʱ��16gҺ̬�״���ȫȼ�գ����ָ���ԭ״̬ʱ���ų�363.3kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��4��ѡ�ú��ʵĺϽ�Ϊ�缫�����������ơ��״���ˮ������Ϊԭ�ϣ������Ƴ�һ���Լ״�Ϊԭ�ϵ�ȼ�ϵ�أ��˵�صĸ���Ӧ�����ͨ��������� ���������ĵ缫��Ӧʽ�ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪���淴ӦCO��H2O(g)  CO2��H2���ﵽƽ��ʱ��K��
CO2��H2���ﵽƽ��ʱ��K��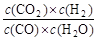 ��K�dz�����ֻ���¶��йأ���Ũ���ء�
��K�dz�����ֻ���¶��йأ���Ũ���ء�
��1��830Kʱ������ʼʱ��c(CO)��2mol/L��c(H2O)��3mol/L��ƽ��ʱCO��ת����Ϊ60%��ˮ������ת����Ϊ ��KֵΪ ��
��2��830K����ֻ����ʼʱc(H2O)��Ϊ6mol/L����ˮ������ת����Ϊ ��
��3����830Kʱ����ʼŨ��c(CO)��a mol/L��c(H2O)��b mol/L��H2��ƽ��Ũ��c(H2)��c mol/L��a��b��c֮��Ĺ�ϵʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��֪��CO(g)+H2O(g)  CO2(g)+H2(g) ��H=Q����ƽ�ⳣ�����¶ȱ仯���±���ʾ��
CO2(g)+H2(g) ��H=Q����ƽ�ⳣ�����¶ȱ仯���±���ʾ��
| �¶�/�� | 400 | 500 | 850 |
| ƽ�ⳣ�� | 9.94 | 9 | 1 |
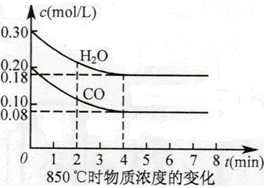
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com