
| 5 |
| 12 |
| 1 |
| 1 |
| 5 |
| 12 |
| 1 |
| 1 |
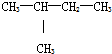 ,
,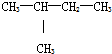 ;
;

 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:

| A、Cu为正极发生氧化反应 |
| B、负极反应为 Zn-2e-═Zn2+ |
| C、电子由铜片通过导线流向锌片 |
| D、该装置能将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c2(H2)?c(CO2) |
| c2(H2O) |
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
| 催化剂 |
投料比[
|
500K | 600K | 700K | 800K | ||
| 1.5 | 45% | 33% | 20% | 12% | ||
| 2.0 | 60% | 43% | 28% | 15% | ||
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L H2和O2的混合气体中所含的分子数为NA |
| B、21.6g X单质与Cl2完全反应,生成106.8gX Cl3,则X的相对原子质量为27 |
| C、浓度均为0.10mol?L-1的醋酸和醋酸钠溶液等体积混合后:c(CH3COO-)-(CH3COOH)=2[c(H+)-c(OH-)] |
| D、500mL 0.10mol?L-1 FeSO4溶液中,Fe2+的物质的量浓度是0.10mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com