
| A. | 氨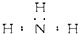 | |
| B. | 四氯化碳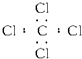 | |
| C. | 氮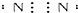 | |
| D. | 二氧化碳${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$C${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
分析 A、N原子的最外层有5个电子,其中3个未成对电子和1对成对电子;
B、四氯化碳的电子式中,氯原子的最外层达到8电子稳定结构,漏掉了氯原子的最外层3对未成键电子;
C、氮气中存在三对共用电子对,为三键;
D、二氧化碳中存在两个碳氧双键.
解答 解:A、N原子的最外层有5个电子,其中3个未成对电子和1对成对电子,3个未成对电子分别和3个H原子形成3对共用电子对,故氨气的电子式为 ,故A错误;
,故A错误;
B、四氯化碳分子中含有4个碳氯键,碳原子和氯原子最外层达到8电子稳定结构,四氯化碳正确的电子式为: ,故B错误;
,故B错误;
C、氮气的电子式为 ,故C正确;
,故C正确;
D、二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为: ,故D错误.
,故D错误.
故选C.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的正确表示方法,并区分离子化合物和共价化合物电子式的书写方式的不同.


科目:高中化学 来源: 题型:实验题
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈橙红色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极上Fe发生还原反应 | |
| B. | 放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 | |
| C. | 放电时,Ni(OH)2是还原产物 | |
| D. | 该蓄电池放电过程和充电过程发生的是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液:Fe2+、Mg2+、NO3-、SO42- | |
| B. | 由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl- | |
| C. | 含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl- | |
| D. | pH=12的溶液:Na+、K+、〔Al(OH)4〕-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

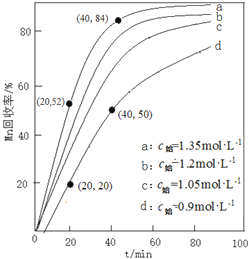
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入足量稀硫酸,无明显现象,再加入AgNO3溶液,出现白色沉淀,则溶液中有Cl- | |
| B. | 向某溶液中滴加浓硫酸,将产生的气体通入品红溶液中,品红褪色,则溶液中一定有SO32- | |
| C. | 用洁净的铂丝蘸取某溶液在无色火焰上灼烧,透过蓝色钴玻璃观察火焰呈紫色,则溶液中有K+ | |
| D. | 在某溶液中,先加入足量BaCl2溶液,有白色沉淀生成;再加入足量稀盐酸,沉淀不溶解,则证明该溶液中含SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com