
 硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下: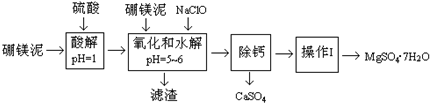
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 20 | 40 | 50 | 60 | 70 |
| MgSO4 | 25.0 | 31.8 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.256 | 0.212 | 0.207 | 0.201 | 0.190 |
分析 硼镁泥主要成份是MgO(占35%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸,MgO、CaO、MnO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤除去滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,滤液中含钙离子、镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体.
(1)从影响反应速率的因素分析;
(2)溶液里还原性的离子有Mn2+、Fe2+,能被NaClO溶液氧化并生成对应的MnO2、Fe(OH)3沉淀,可结合电子守恒、电荷守恒及原子守恒配平得到相应离子反应反应方程式;
(3)为使溶液里Fe3+、Al3+完全水解转化为沉淀并除去多余的NaClO,提高产品的纯度,通常通过增大另一种反应物的量来达到;
(4)根据表中温度对硫酸镁、硫酸钙的影响完成;析出晶体后的溶液(20℃)为MgSO4的饱和溶液,可结合此温度下MgSO4的溶解度为25g,设饱和溶液质量为125g,则所含溶质MgSO4的质量为25g,再根据物质的量浓度的计算求算物质的量浓度;
(5)ZnFeO3.5和SO2在加热条件下生成ZnFeO4、S,电解硫酸锰时,生成二氧化锰和硫酸,阳极上失电子发生氧化反应.
解答 解:硼镁泥主要成份是MgO(占35%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸,MgO、CaO、MnO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤除去滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,滤液中含钙离子、镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体.
(1)升高温度,增大接触面积,搅拌、增大反应物的浓度都可加快反应速率,故答案为:升温;把硼镁泥粉碎、搅拌等;
(2)NaClO能将溶液中的还原性离子Mn2+、Fe2+氧化生成沉淀发生反应的离子方程式为:Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cll-+4H+;
故答案为:Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cll-+4H+;
(3)通过加入过量的硼镁泥调节溶液的pH,使溶液里Fe3+、Al3+完全水解转化为沉淀,同时除去过量的NaClO;
故答案为:调节溶液pH,使Fe3+、Al3+水解完全,除去多余的NaClO;
(4)有温度对硫酸镁、硫酸钙的溶解度影响,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙;20℃时饱和MgSO4溶液质量为125g,其体积为$\frac{125g}{1.20g•c{m}^{-3}}$;所含溶质MgSO4的质量为25g,物质的量为$\frac{25g}{120g/mol}$;则溶液里c(Mg2+)=c(MgSO4)=$\frac{\frac{25g}{120g/mol}}{\frac{125g}{1.20g•c{m}^{-3}}×1{0}^{-3}L/c{m}^{3}}$=2.00mol/L;
故答案为:趁热过滤;2.00;
(5)ZnFeO3.5和SO2在加热条件下生成ZnFeO4、S,反应方程式为4ZnFeO3.5+SO2$\frac{\underline{\;△\;}}{\;}$4ZnFeO4+S;电解硫酸锰时,生成二氧化锰和硫酸,阳极上失电子发生氧化反应,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,
故答案为:4ZnFeO3.5+SO2$\frac{\underline{\;△\;}}{\;}$4ZnFeO4+S;Mn2+-2e-+2H2O=MnO2+4H+.
点评 本题考查了从硼镁泥中提取MgSO4•7H2O的方法,涉及了配制一定物质的量浓度的溶液的仪器选择、铁离子检验方法、硫酸镁晶体的产率计算等知识,题量较大,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NO2的反应速率与NO的反应速率相等 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的密度不再改变的状态 | |
| D. | 单位时间内生成n molO2的同时生成2nmolNO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 配料 | 水、果汁、白砂糖、食品添加剂 | |||||
| 项目 | 糖类 | 维生素 | 柠檬味酸 | 氯 | 钠 | 碘 |
| 每100g | 42.5g | 200mg | 100mg | 50mg | 90mg | 3.5mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: | |
| B. | 铝离子的结构示意图: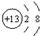 | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{45}$Br | |
| D. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y元素的主族序数之差为1 | |
| B. | 若X+、Y2-相差两个电子层,则X2Y可能是离子化合物也可能是共价化合物 | |
| C. | 若X+、Y2-核外电子数相差8,则原子半径Y>X | |
| D. | 若X+、Y2-具有相同的电子层结构,则离子半径X+>Y2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙酸乙酯中的乙酸,用饱和碳酸钠水溶液洗涤后分液 | |
| B. | 用燃烧的方法可以鉴别乙醇、苯和四氯化碳 | |
| C. | 要除去甲烷中的乙烯,可选用溴水 | |
| D. | 甲烷和氯气按体积比1:3混合,可制得纯净的CHCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com