
| A. | 使 pH 试纸呈红色的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | pH=13的溶液:S2-、SO32-、SO42-、Na+ | |
| C. | 使红色石蕊试纸变蓝色的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 含有溶质为K2SO4的溶液:AlO2-、Na+、Al3+、Ba2+ |
分析 A.使pH试纸呈红色的溶液,显酸性;
B.pH=13的溶液,显碱性;
C.使红色石蕊试纸变蓝色的溶液,显碱性;
D.离子之间结合生成沉淀,离子之间相互促进水解.
解答 解:A.使pH试纸呈红色的溶液,显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故A错误;
B.pH=13的溶液,显碱性,该组离子之间不反应,可大量共存,故B正确;
C.使红色石蕊试纸变蓝色的溶液,显碱性,HCO3-、OH-、Ba2+结合生成沉淀和水,不能大量共存,故C错误;
D.SO42-、Ba2+结合生成沉淀,AlO2-、Al3+相互促进水解,不能大量共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、水解反应、氧化还原反应的离子共存考查,综合性较强,题目难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 31g白磷中含有的共价键数目为1.5NA | |
| B. | 0.1L3.0mol•L-1的NH4N03溶液中含有的NH4+的数目为0.3NA | |
| C. | 标准状况下,22.4L己烷中含共价键数目为19NA | |
| D. | 常温常压下,lmolCl2与足量的水充分反应,转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
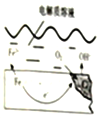 如图是钢铁在潮湿空气能发生电化学腐蚀原理示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈
如图是钢铁在潮湿空气能发生电化学腐蚀原理示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与浓硝酸反应:Cu+4H++4NO3-═Cu2++4NO2↑+2H2O | |
| B. | 氨水与醋酸溶液反应:NH3•H2O+CH3COOH═NH4++CH3COO-+H2O | |
| C. | 过氧化钠溶于水:2O2-+2H2O═4OH-+O2↑ | |
| D. | 小苏打与氢氧化钠溶液混合:HCO3-+OH-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 右;( M+2Q) | B. | 右;(M+4Q ) | C. | 左;(M+2Q) | D. | 左;(M+4Q) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出水分子的电子式
,写出水分子的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O中所含的电子总数为10NA个 | |
| B. | 1 L 1 mol•L-1的盐酸中含有的HCl分子数为NA个 | |
| C. | 1 mol I2晶体完全升华后所得气体的体积约为22.4 L | |
| D. | 常温下78 g Na2O2中含有O2-的数目为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ⅰ和II两途径达到平衡时,体系内各成分的体积分数相同 | |
| B. | 达到平衡时,Ⅰ途径的反应速率v(H2)等于Ⅱ途径的反应速率v(H2) | |
| C. | 达到平衡时,Ⅱ途径体系内混合气体的压强是Ⅰ途径内混合气体压强的2倍 | |
| D. | 达到平衡时,Ⅰ途径体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的$\frac{1}{2}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com