
(11分)(1)已知:①Fe(s)+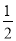 O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+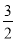 O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是 。
某同学认为,铝热反应可用于工业炼铁,你的判断是 (填“能”或“不能”),
你的理由是 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,
如图所示。
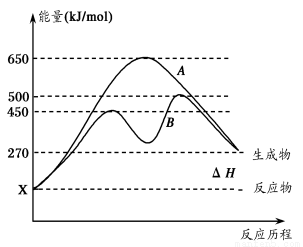
①据图判断该反应是___(填“吸”或“放”)热反应,当反应达到平衡后,其他
条件不变,升高温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:H2(g)+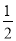 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为 。
(11分)
(1)3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s) ΔH=-859.7 kJ·mol-1(2分)
不能(1分) 该反应为引发反应,需消耗大量能量,成本高(2分)
(2)吸(1分) 增大(1分) D (2分)
(3)409kJ/mol(2分)
【解析】
试题分析:(1)根据盖斯定律Al与FeO的反应的热效应ΔH=②-3①=-1675.7 kJ·mol-1-3(-272.0 kJ·mol-1)=-859.7kJ/mol,所以该反应的热化学方程式为3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s) ΔH=-859.7 kJ·mol-1;该反应不能用于工业炼铁,因为用该反应炼铁时需消耗大量冶炼成本更高的Al,消耗大量能量,成本高,无经济效益;
(2)①该反应的反应物的总能量低于生成物的总能量所以是吸热反应;升高温度,正逆反应的速率都增大;②B的历程说明,没改变反应热,但降低了该反应的活化能,所以是使用了催化剂,答案选D;
(3)活化能是反应物的总能量与反应时的最高能量的差值,逆反应的反应物即正反应的生成物,所以逆反应的活化能=正反应的活化能+逆反应的反应热=167.2+241.8=409kJ/mol。
考点:考查盖斯定律的应用,活化能的计算


科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 3Zn+2K2FeO4+8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是:
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是:
A.放电时负极反应为:Zn-2e—+2OH—=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 -3e—+ 5OH—=FeO42-+ 4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:填空题
(14分)碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32-  2I-+ S4O62-(快)
2I-+ S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx mL,理由是 。
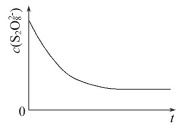
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s) 2LiI(s) ΔH
2LiI(s) ΔH
已知: ①4Li(s)+O2(g) 2Li2O(s) ΔH1
2Li2O(s) ΔH1
②4LiI(s)+O2(g) 2I2(s)+2Li2O(s) ΔH2
2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH= ;碘电极作为该电池的 极。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:选择题
关于下列各装置图的叙述中,不正确的是
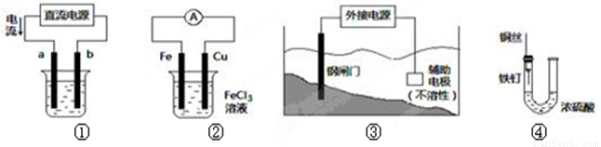
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:选择题
有专家指出,如果对燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合,使之能够实现如图转化,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为
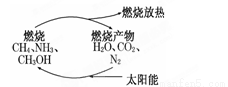
A.化学能 B.热能
C.生物能 D.电能
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:选择题
在由水电离产生的H+浓度为1×10-13mol/L的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO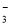 、S2- ②K+、Fe2+、I-、SO
、S2- ②K+、Fe2+、I-、SO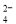 ③ Na+、Cl-、NO
③ Na+、Cl-、NO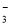 、SO
、SO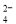
④Na+、Ca2+、Cl-、HCO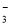 ⑤ K+、Ba2+、Cl-、NO
⑤ K+、Ba2+、Cl-、NO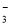
A.①③ B.③⑤ C.③④ D.②⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:选择题
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol -1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.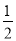 H2SO4(aq)+
H2SO4(aq)+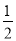 Ba(OH)2(aq)=
Ba(OH)2(aq)=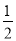 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(A)试卷(解析版) 题型:选择题
已知可逆反应X(g)+2Y(g) Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如下图所示,则下列说法正确的是
Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如下图所示,则下列说法正确的是

A.a点正反应速率大于逆反应速率
B.增大X的浓度,X的转化率增大
C.容器中压强恒定时,不能说明反应已达平衡状态
D.保持温度和密闭容器的压强不变,再充入1 mol X和2 mol Y,再次达到平衡时n(Z)/n(X)的值会变小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高一上第一次考试化学(A)试卷(解析版) 题型:选择题
如果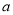 g某气体中含有的分子数为
g某气体中含有的分子数为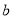 ,则
,则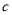 g该气体在标准状况下占有的体积应为(式中NA为阿伏加德罗常数)( )
g该气体在标准状况下占有的体积应为(式中NA为阿伏加德罗常数)( )
A.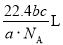 B.
B.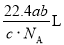 C.
C.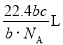 D.
D.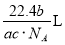
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com