
| A. | S(s)+O2(g)→SO2(g)△H1 S(g)+O2(g)→SO2(g)△H2 | |
| B. | 2H2(g)+O2(g)→2H2O(l)△H 1 2H2(g)+O2(g)→2H2O(g)△H2 | |
| C. | NaOH(aq)+HCl(aq)→NaCl(aq)+H2O(l)△H1 NaOH(aq)+CH3COOH(aq)→CH3COONa(aq)+H2O(l)△H2 | |
| D. | H2(g)+F2(g)→2HF(g)△H1 H2(g)+Cl2(g)→2HCl(g)△H2 |
分析 A.硫和氧气反应为放热反应,△H<0,硫固态变为气态需吸热;
B.氢气和氧气反应为放热反应,△H<0,气态水变为液态需放热;
C.酸和碱中和反应为放热反应,△H<0,弱电解质电离需吸收热量;
D.氢气和氟气反应、氢气和氯气反应都为放热反应,但氟气活泼性强于氯气,生成的氟化氢更稳定,反应放出的热量更多.
解答 解:A.硫和氧气反应为放热反应,硫固态变为气态需吸热,所以第一个反应放出的热量小于第二个反应,因放热△H<0,所以第二个反应负得更多,所以△H1>△H2,故A正确;
B.氢气和氧气反应为放热反应,气态水变为液态需放热,所以第一个反应放出的热量大于第二个反应,因放热△H<0,所以第一个反应负得更多,所以△H1<△H2,故B错误;
C.酸和碱中和反应为放热反应,乙酸为弱酸电离出氢离子需吸收热量,所以第一个反应放出的热量大于第二个反应,因放热△H<0,所以第一个反应负得更多,所以△H1<△H2,故C错误;
D.体系能量越低越稳定,氢气和氟气反应、氢气和氯气反应都为放热反应,但氟气活泼性强于氯气,生成的氟化氢更稳定,反应放出的热量更多,所以第一个反应放出的热量大于第二个反应,因放热△H<0,所以第一个反应负得更多,所以△H1<△H2,故D错误;
故选A.
点评 本题考查了反应热大小比较,注意放热反应△H<0为解答关键,同时注意物质的聚集状态、弱电解质的电离与反应热的关系,题目难度中等.


科目:高中化学 来源: 题型:解答题
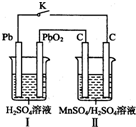 锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为Mn2+-2e-+2H20=MnO2+4H+.
锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为Mn2+-2e-+2H20=MnO2+4H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
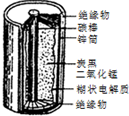 某学校设计了一节实验活动课,让学生从废旧的锌锰酸性干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题:
某学校设计了一节实验活动课,让学生从废旧的锌锰酸性干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 25℃、101 kPa,1molNa在O2中完全燃烧放出255.5KJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液雕刻工艺玻璃上的纹饰 | |
| B. | 海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化 | |
| C. | 用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 | |
| D. | 淀粉、蛋白质、脂肪是人体必需的营养物质.它们都是天然高分子化合物,一定条件下都能发生水解和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +319.68kJ•mol-1 | B. | +259.7kJ•mol-1 | C. | -319.68kJ•mol-1 | D. | -259.7kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 137表示质量数 | B. | 137表示中子数 | ||
| C. | 该原子质子数大于中子数 | D. | 该原子的K、L层共容纳了10个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com