
| 化学式 | 电离常数 |
| HClO | Ki=3×10-8 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
| A、c(Na+)>c(HCO3-)+c(ClO-)+2c(CO32-) |
| B、c(ClO-)>c(HCO3-)>c(H+) |
| C、c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| D、c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| 1 |
| 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图(反应条件已略去),请填空:
A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图(反应条件已略去),请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同浓度的下列溶液中:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,c(NH4+)由大到小的顺序是:①>③>② |
| B、常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH4+)>c(Cl-) |
| C、0.2mol?L-1Na2CO2溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| D、0.1 mol?L-1的NH4Cl溶液与0.05mol?L-1NaOH溶液等体积混合:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol-OH中含有的质子数为9NA |
| B、lmol2,3-丁二醇分子中含C一C数目为4NA |
| C、1 L 1 mol.L-1 FeCl3 溶液中含有 Fe3+ 数为 NA |
| D、71 g氯气参与反应,电子转移数目一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
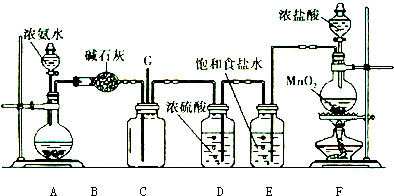
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 的结构中含有酯基 的结构中含有酯基 |
| B、1-丁烯和2-甲基-1-丙烯的加氢产物相同 |
| C、180g葡萄糖可水解生成2mol乳酸(C3H6O3) |
| D、油脂和蛋白质都是能发生水解反应的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在熔融状态下,1mol Na2O2完全电离出的离子数目为4NA |
| B、一定温度下,1L 0.50mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液中含NH4+物质的量不同,且NH4+的数目均小于0.5NA |
| C、28g乙烯和28g丙烯中均含有6NA对共用电子对 |
| D、1mol羟基(-OH)中所含电子总数为9NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com