
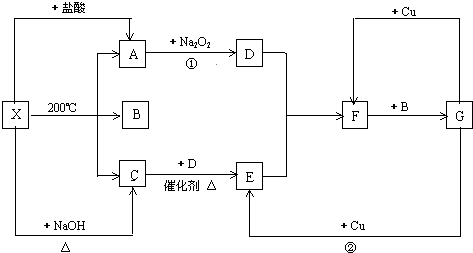
分析 X既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3,气体A能与过氧化钠反应,故A为CO2,则A应为(NH4)2CO3或NH4HCO3,B为H2O,结合转化关系可知,D为O2,E为NO,F为NO2,G为HNO3,结合物质的性质进行解答.
解答 解:X既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3,气体A能与过氧化钠反应,故A为CO2,则A应为(NH4)2CO3或NH4HCO3,B为H2O,结合转化关系可知,D为O2,E为NO,F为NO2,G为HNO3,
(1)由上述分析可知,物质X可以是(NH4)2CO3或NH4HCO3,C是NH3,F是NO2,故答案为:(NH4)2CO3或NH4HCO3;NH3;NO2;
(2)反应①的化学方程式是:2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(3)反应②的离子方程式是:3Cu+2NO3-+8H+=3Cu2++4H2O+2NO↑,
故答案为:3Cu+2NO3-+8H+=3Cu2++4H2O+2NO↑.
点评 本题考查无机物的推断,X能与酸、碱反应生成气体A、C为推断突破口,然后利用转化关系推出各物质,题目难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
. .
. ,该化合物是由极性(填“极性”或“非极性”)共价键形成的.
,该化合物是由极性(填“极性”或“非极性”)共价键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
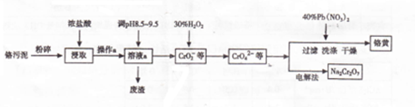
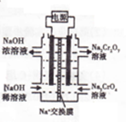
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
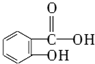 ,俗名水杨酸.
,俗名水杨酸. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | CO2 | C. | NH3 | D. | CO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现欲用纯净的锌粒与稀盐酸反应制取H2,请回答:
现欲用纯净的锌粒与稀盐酸反应制取H2,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓ | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、钴、镍等金属及其化合物在工业上有重要用途.请回答:
铁、钴、镍等金属及其化合物在工业上有重要用途.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com