
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
Ⅰ.(1)同浓度的CH3COO-、HCO、CO![]() 、HC2O4- 、ClO-、S2-结合H+的能力最弱的____________。
、HC2O4- 、ClO-、S2-结合H+的能力最弱的____________。
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的
是________(填序号)。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D. ![]()
若该溶液升高温度,上述4种表达式的数据增大的是_________________。
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH 变化如图所示,则稀释后,醋酸溶液中由水电离出来的c(H+)_______(填“大于”、“等于”或“小于”)HX 溶液中由水电离出来的c(H+)。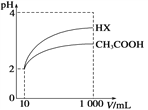
Ⅱ.(1)下列化学方程式可能正确的是______________。
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
(2)写出过量CO2通入Na2S溶液中的离子方程式______________________________________。
(3)将过量的氯气通入到少量的碳酸钠溶液中_______________________________________。
【答案】 HC2O4- A ABCD 小于 BD 2CO2 + 2S2- + 2H2O = 2HS- + 2HCO3 - ![]() (
(
【解析】Ⅰ.(1)K值越小结合氢离子能力越强,查数据可知:同浓度的CH3COO-、HCO、CO![]() 、HC2O4- 、ClO-、S2-结合H+的能力最弱的HC2O4-;
、HC2O4- 、ClO-、S2-结合H+的能力最弱的HC2O4-;
(2)A.CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,故A选;B.c(H+)/c(CH3COOH)=n(H+)/n(CH3COOH),则稀释过程中比值变大,故B不选;C.稀释过程,促进电离,c(H+)减小,c(OH-)增大,c(H+)×c(OH-)=Kw,Kw不变,故C不选;D.稀释过程,促进电离,c(H+)减小,c(OH-)增大,则c(OH-)/c(H+)变大,故D不选;弱电解质电离是吸热反应,故升高温度,上述4种表达式的数值均变大;
(3)等pH的pH=2的醋酸溶液与一元酸HX稀释相同位数,HX变化值大,说明HX的酸性大于醋酸,则稀释后,醋酸溶液抑制水的电离能力大于HX,则水电离出来的c(H+)小于HX。
Ⅱ.(1)由比较草酸与碳酸的各级电离平衡常数大小,常数越小的对应微粒越易得到质子,因草酸二级电离平衡常数大于碳酸的一、二级电离平衡常数,所以BD正确。
同理,碳酸一级电离大于氢硫酸的一级电离,但其二级电离小于氢硫酸的一级电离,故过量CO2通入Na2S溶液中的离子方程式:2CO2 + 2S2- + 2H2O = 2HS- + 2HCO3 -;(3)氯气与水反应生成盐酸和次氯酸,次氯酸的电离平衡常数介于碳酸的一、二级常数之间,故过量的氯气通入到少量的碳酸钠溶液中的离子方程式为: ![]()


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室探究氨的有关性质,设计了下图所示实验,A处是气体发生装置,A中所用的实验药品从下列物质中选取.
①碳酸钠 ②碳酸氢钠 ③碳酸氢铵 ④氯化铵 ⑤熟石灰 ⑥氢氧化钠

按上图连接好各仪器,现将C处的铂丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯,部分实验的现象如下:铂丝继续保持红热状态,D中的铜片慢慢溶解,回答下列问题:
(1)若A中制取气体时只用了一种药品,则该药品是 (填物质序号)
(2)B装置的作用为
(3)D中铜片发生反应的离子方程式为 ,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的 (填下列各项序号)
A.Na2CO3 B.AgNO3 C.H2SO4 D.FeSO4
(4)图E中持续通人氧气的作用为 。
(5)有人认为他们设计的这套实验装置还存在明显的不足,对其不足之处以及应如何改进,谈谈你的意见: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不利于环境保护的是( )
A. 推广使用无铅汽油 B. 提倡家庭使用太阳能热水器
C. 推广废旧电池单独回收 D. 提倡家庭购买大排量汽车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 常温常压下,11.2L氧气所含的原子数为NA
B. 1.8g的NH4+离子中含有的电子数为0.1NA
C. 常温常压下,48gO3含有的氧原子数为3NA
D. 2.4g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2。该反应的还原产物为______。
(2)已知反应2HI(g)![]() H2(g)+I2(g)的△H = +11 kJ·mol-1,l molH2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(s)分子中化学键断裂时需吸收的能量为______kJ。
H2(g)+I2(g)的△H = +11 kJ·mol-1,l molH2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(s)分子中化学键断裂时需吸收的能量为______kJ。
(3)Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)。在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)。在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为__________________。
②上述反应中,正反应速率为![]() 正=k正x2(HI),逆反应速率为
正=k正x2(HI),逆反应速率为![]() 逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为____________________(以K和k正表示)。若k正=0.0027 min-1,在t = 40 min时,
逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为____________________(以K和k正表示)。若k正=0.0027 min-1,在t = 40 min时, ![]() 正 = _______________min-1。
正 = _______________min-1。
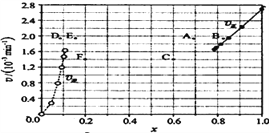
③由上述实验数据计算得到![]() 正~x(HI)和
正~x(HI)和![]() 逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。
逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含碘元素。从海带中提取碘有如下步骤:①在滤液中通入足量Cl2;②将海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗分液;⑤过滤。合理的操作顺序是( )
A. ①②③④⑤ B. ②⑤①③④ C. ①③⑤②④ D. ②①③⑤④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com