
阅读下表中短周期主族元素的相关信息并填空。
元素代号 | 相关信息 |
A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
B | B的原子最外层电子数是其内层电子数的三倍 |
C | 是地壳中含量最高的金属元素 |
D | A、B、D组成的化合物X是84消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
(1)E元素周期表中的位置 ;C的原子结构示意图 。
(2)X的化学式为 。
(3)A、B、D三种元素形成的简单离子半径由大到小的顺序为 (用离子符号表示)。
(4)A、B形成的一种原子个数比为1:1化合物的化学式为 。
(5)A在真空高压下能与由元素D、E组成化合物ED4反应生成两种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称。写出该反应的化学方程式 。
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:选择题
下列关于物质性质的比较,不正确的是 ( )
A.酸性强弱:HIO4>HBrO4>HClO4 B.原子半径大小:Al>P>N
C.碱性强弱:KOH>NaOH>LiOH D.金属性强弱:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第八次模拟理综化学试卷(解析版) 题型:选择题
断裂1mol丙烷分子中所有共价键需要4006 kJ的能量,而断裂1mol新戊烷分子中所有共价键需要6356 kJ的能量。则C—C键的平均键能为( )
A.386 kJ/mol B.347kJ/mol C. 368 kJ/mol D.414 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016届江西南昌二中、临川一中等高三4月联考二理综化学试卷(解析版) 题型:实验题
【化学—化学与技术】
工业合成上氨及氨氧化法制硝酸的流程图如下,回答下列问题:
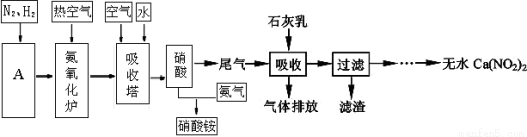
(1)工业合成氨的原料是N2和H2。设备A的名称是 ;其中N2可从空气中分离出来,方法是先将空气 ,然后 即可得到;H2可以水和天然气为原料在催化剂作用下高温制取,其化学方程式为_________ 。
(2)在原料气制备过程中必须进行脱硫,目的是____________________。
(3)利用石灰乳来除去硝酸工业的尾气(含NO、NO2),既能净化尾气,又能获得应用广泛的Ca(NO2)2,已知NO和NO2按1:1通入碱液中生成亚硝酸盐。
①上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是 ;滤渣可循环使用,滤渣的主要成分是 (填化学式)。
②该工艺需控制NO 和NO2 物质的量之比接近1:1。若n(NO):n(NO2)>1:1,则会导致 ;若n(NO):n(NO2)<1:1,则会导致 。
(4) 某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是95%,NO制HNO3的产率是90%,则制HNO3所用的NH3的质量占总耗NH3质量的 %(保留三位有效数值)。
查看答案和解析>>
科目:高中化学 来源:2016届江西南昌二中、临川一中等高三4月联考二理综化学试卷(解析版) 题型:选择题
短周期元素A、B、C、D最高价氧化物对应水化物分别为W、X、Y、Z,A是短周期中原子半径最大的元素,常温下W、Y、Z均可与X反应,A、C、D的原子序数及0.1 mol/LW、Y、Z溶液的pH如图所示。下列说法正确的是
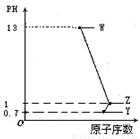
A.B的离子半径大于A的离子半径
B.C氢化物稳定性大于D氢化物稳定性
C.W、Z两物质含有的化学键类型相同
D.B原子的电子层数与最外层电子数相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是

A.X、W、Z元素的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2和WX3均属于离子化合物
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是
金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | |||
A. | Mg | 0.1 | 6mol/L盐酸 | 10mL | 30℃ |
B. | Mg | 0.1 | 3mol/L盐酸 | 10mL | 60℃ |
C. | Fe | 0.1 | 3mol/L盐酸 | 10mL | 60℃ |
D. | Mg | 0.1 | 6mol/L盐酸 | 10mL | 60℃ |
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:简答题
生活用水的净化、消毒杀菌处理与生产、生活废水的无害化处理与我们的生活密切相关,回答下列问题。
(1)暂时硬度水与永久硬度水煮沸后会出现白色固体的是___________水,除去水垢中CaSO4的试剂是纯碱、盐酸,写出除去CaSO4的离子反应方程式______________________、______________________。
(2)K2FeO4是一种新型的水处理剂,它兼有消毒杀菌、净水双重功能,具有消毒杀菌功能是因为它有___________性。但若水的酸性或碱性较强,该试剂的净水功能均会减弱甚至消失,原因是____________________________________________。
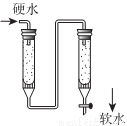
(3)右图是离子交换柱结构示意图,则左侧的是___________(填阴或阳)离子交换柱。硬度为1毅的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)的水。若某天然水中其它离子转化后相当于有c(Ca2+)=1.0×10-3mol/L,此水是否符合我国饮用水的硬度标准为___________(生活用水卫生标准规定,总硬度不超过450mg/L,写出计算式)。
(4)用双硫腙(H2Dz)~CC14络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Hg(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
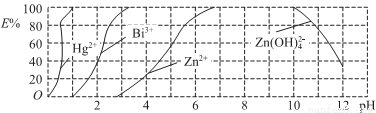
①当废水的pH=4时,废水中能以简单金属离子形式存在的离子是___________。
②当水中n(Bi3+):n[Bi(HDz)3]=3:2时,废水的pH=___________。
③向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头九中高一下第一次月考化学试卷(解析版) 题型:选择题
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为
2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如下图所示。
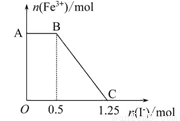
则下列有关说法不正确的是
A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D.向C点以后的溶液中加入少量KSCN溶液,溶液变红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com