
【题目】向20mL某物质的量浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如图所示.则:
(1)写出OA段发生反应的离子方程式:OA段 ,图中线段OP:PB= .
(2)计算原AlCl3溶液的物质的量浓度为 mol/L
(3)图中A对应的横坐标为 mL
(4)当加入5ml NaOH溶液时,产生沉淀量为 mol.
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为 .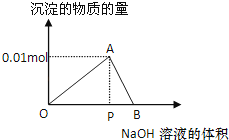
【答案】Al3++3OH﹣=Al(OH)3↓;3:1;0.5;15;0.0033;18.33
【解析】(1)依据分析可知OA段发生的 反应是氯化铝和氢氧化钠反应生成氢氧化铝沉淀至最大量的过程,反应离子方程式为:Al3++3OH﹣=Al(OH)3↓; AB段发生的是氢氧化铝溶解在氢氧化钠溶液中至沉淀全部溶解,根据反应①Al3++3OH﹣=Al(OH)3↓,②Al(OH)3+OH﹣=AlO2﹣+2H2O得到生成最大量沉淀和沉淀全部溶解所消耗氢氧化钠物质的量为3:1,氢氧化钠溶液浓度一定,所以溶液体积比为3:1;所以答案是:Al3++3OH﹣=Al(OH)3↓,3:1;
(2)图象中分析得到最大量氢氧化铝沉淀物质的量为0.01mol,所以氯化铝物质的量为0.01mol,溶液浓度=![]() =0.5mol/L;所以答案是:0.5;
=0.5mol/L;所以答案是:0.5;
(3)图象中分析得到最大量氢氧化铝沉淀物质的量为0.01mol,所以消耗氢氧化钠物质的量为0.03mol,氢氧化钠溶液的体积=![]() =
=![]() =0.015L=15ml;所以答案是:15;
=0.015L=15ml;所以答案是:15;
(4)当加入5ml NaOH溶液时,产生沉淀量依据反应Al3++3OH﹣=Al(OH)3↓;计算得到:
Al3++3OH﹣=Al(OH)3↓;
1 3 1
0.005L×2mol/L n
n=0.0033mol;所以答案是:0.0033;
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,则发生反应Al3++3OH﹣=Al(OH)3↓,Al(OH)3+OH﹣=AlO2﹣+2H2O,最大量沉淀为0.01mol,消耗氢氧化钠物质的量为0.03mol,溶解沉淀物质的量=0.01mol﹣0.0033mol=0.0067mol;消耗氢氧化钠0.0067mol;所以共消耗氢氧化钠物质的量=0.0067mol+0.03mol=0.0367mol;需要氢氧化钠溶液体积=![]() =0.01833L=18.35ml;所以答案是:18.35;
=0.01833L=18.35ml;所以答案是:18.35;


科目:高中化学 来源: 题型:
【题目】COCL2俗名作光气,是有毒气体.在一定条件下,可发生的化学反应为:COCL2(g) ![]() CO(g)+CL2(g)△H<0.下列有关说法正确的是( )
CO(g)+CL2(g)△H<0.下列有关说法正确的是( )
A.在一定条件下,使用催化剂能加快反应速率并提高反应物的平转化率
B.当反应达平衡时,恒温恒压条件下通人Ar,能提高COCl2的转化率
C.单位时间内生成CO和CL2的物质的量比为1:1时,反应达到平衡状态
D.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5 . 回答下列问题.
(1)已知AX3的熔点和沸点分别为﹣93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成lmol AX5 , 放出热量123.8kJ.该反应的热化学方程式为 .
(2)反应AX3(g)+X2(g)AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.
①下列不能说明反应达到平衡状态的是 .
A.混合气体的平均相对分子质量保持不变
B.混合气体密度保持不变
C.体系中X2的体积分数保持不变
D.每消耗1molAX3同时消耗1molAX5
②计算实验a从反应开始至达到平衡时的反应速率v(AX5)=(保留2位有效数字).
③图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为(填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b、c . 该反应在实验a和实验c中的化学平衡常数的大小关系是KaKc(填“>、<或=”),其中Kc=(保留小数点后1位).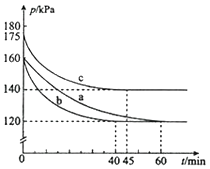
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA
B.4.2 g C3H6中含有的碳碳双键数一定为0.1 NA
C.1 mol﹣OH中电子数为10 NA
D.标准状况下,2.24 L CHCl3的原子总数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于阿伏加德罗常数的说法不正确的是( )
A.阿伏加德罗常数是一个纯数,没有单位
B.常用NA表示阿伏加德罗常数
C.阿伏加德罗常数是一个实验值
D.阿伏加德罗常数常用:6.02×1023mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在![]() H、
H、![]() H、
H、![]() H、
H、![]() Mg、
Mg、![]() Mg和
Mg和![]() Cu中共有______种元素,______种原子。
Cu中共有______种元素,______种原子。
(2)在①CaCl2、②KOH、③He、④H2SO4、⑤Na2O2、⑥I2中,不含离子键的是_______(填序号),含有极性共价键的是________(填序号)。
(3)电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式为:Zn+2OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-
电池的负极是_____(写电极符号),正极发生的是____________反应(填反应类型),总反应式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp(AgCl)=1.8×10﹣10 , Ksp(AgI)=1.5×10﹣16 , Ksp(Ag2CrO4)=2.0×10﹣12 , 则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl>AgI>Ag2CrO4
B.AgCl>Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI
D.Ag2CrO4>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是( )
A.锌粒与稀硫酸的反应
B.甲烷在空气中燃烧的反应
C.灼热的木炭与CO2的反应
D.Ba(OH)28H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com