
判断正误,正确的划“√”,错误的划“×”
(1)太阳能是清洁能源( )
(2)化石燃料和植物燃料燃烧时放出的能量均来源于太阳能( )
(3)农村用沼气池产生的沼气作燃料属于生物质能的利用( )
(4)人类利用的能源都是通过化学反应获得的( )
(5)随着科技的发展,氢气将成为主要能源之一( )
(6)食用植物体内的淀粉、蛋白质等属于直接利用能源( )
(7)粮食作物是制乙醇燃料的重要原料( )
(8)化石燃料属于可再生能源,不影响可持续发展( )
(9)开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量( )
(10)开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料( )
(11)低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放( )
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入
0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是( )
A.电解过程中阴极没有气体生成
B.电解过程中转移的电子的物质的量为0.4 mol
C.原CuSO4溶液的浓度为0.1 mol·L-1
D.电解过程中阳极收集到的气体体积为2.24 L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
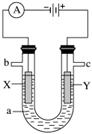
(1)若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞,则:
①电解池中X极上的电极反应式是____________________________________________,
在X极附近观察到的现象是_________________________________________________。
②Y电极上的电极反应式是_______________________________________,
检验该电极反应产物的方法是____________________________________________。
(2)若用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是________________________________________,
电极反应式是__________________________________________。
②Y电极的材料是__________________________________________,
电极反应式是________________________________________________
(说明:杂质发生的电极反应不必写出)。
③当电路中有0.04 mol电子通过时,阴极增重_____________________________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
两个有联系的不同反应相比
C(s)+O2(g)===CO2(g) ΔH1<0
C(s)+ O2(g)===CO(g) ΔH2<0
O2(g)===CO(g) ΔH2<0
则ΔH1____ΔH2。
查看答案和解析>>
科目:高中化学 来源: 题型:
件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
]已知:2NO2(g)??N2O4(g) ΔH1
2NO2(g)??N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。


查看答案和解析>>
科目:高中化学 来源: 题型:
甲同学认为,在水中加入H2SO4,水的电离平衡向左移动,解释是加入H2SO4后c(H+)增大,平衡左移。乙同学认为,加入H2SO4后,水的电离平衡向右移动,解释为加入H2SO4后,c(H+)浓度增大,H+与OH-中和,平衡右移。你认为哪种说法正确?并说明原因。水的电离平衡移动后,溶液中c(H+)·c(OH-)是增大还是减小?
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。请回答下列问题:
(1)甲同学运用沉淀法测定样品中NaOH的含量。该同学选用的药品除样品外,还应有________;实验中应测定的数据有________。
(2)乙同学运用滴定法测定样品中NaOH的含量。
①用分析天平准确称取该样品5.000 0 g,全部溶于水配制成1 000.0 mL溶液。用碱式滴定管量取20.00 mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测。滴定管在使用前除洗涤外,还应____________________________________。
②用浓度为0.100 0 mol·L-1的盐酸标准溶液进行滴定。开始滴定前的一步操作是________。
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次。
④滴定过程中,锥形瓶中溶液的pH变化如下:
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
请在坐标图中绘制出上述中和滴定的曲线。

⑤如表所示是几种酸碱指示剂的变色范围,根据你所作的中和滴定曲线分析,上述中和滴定中应选用的指示剂是________。
| 指示剂 | 变色范围(pH) | 颜色 | |
| 酸 | 碱 | ||
| 甲基橙 | 3.1~4.4 | 红 | 黄 |
| 石蕊 | 5.0~8.0 | 红 | 蓝 |
| 酚酞 | 8.2~10.0 | 无 | 红 |
⑥样品中,NaOH的质量百分含量为____________。
答案 (1)MgCl2溶液 样品质量和加入足量MgCl2溶液后生成的沉淀质量
(2)①检漏、润洗 ②调节盛标准液的滴定管的液面于“0”刻度或“0”刻度以下
④滴定曲线如图所示
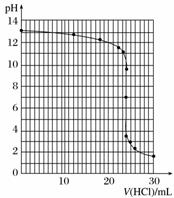
⑤甲基橙或酚酞 ⑥96%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com