

| △c |
| △t |
| 0.6mol/L |
| 60s |
| c2(NO2) |
| c(N2O4) |
| 1.22 |
| 0.4 |
| 11.2L |
| 22.4L/mol |
| 1 |
| 4 |


科目:高中化学 来源: 题型:
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
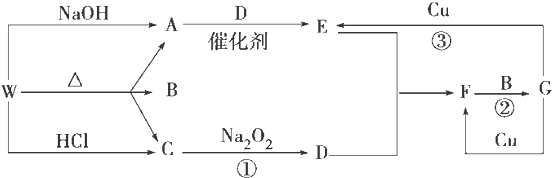
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离平衡常数Ka |
| CH3COOH | Ka=1.76×10-5 |
| H2CO3 | Ka1=4.31×10-7 Ka2=5.61×10-11 |
| H3PO4 | Ka1=7.52×10-3 Ka2=6.23×10-8 Ka3=4.50×10-13 |
| A、温度升高,Ka值减小 |
| B、0.1 mol?L-1 CH3COOH溶液中加入少量冰醋酸,c(H+)/c(CH3COOH)将增大 |
| C、等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(CH3COONa)>pH(Na3PO4) |
| D、PO43-、HPO42-和H2PO4-在溶液中不能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的CH3COOH溶液的浓度小于pH=2的盐酸的浓度 |
| B、向NaHCO3溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO3-)增大 |
| C、将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)=c(HCO3-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 13 |
| 2 |
| 13 |
| 2 |
| 9 |
| 2 |
| 9 |
| 2 |
| A、-2878kJ/mol |
| B、-2658kJ/mol |
| C、-1746kJ/mol |
| D、-1526kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③④ |
| C、②③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 陈述I | 陈述Ⅱ | |
| A | 常温下铁、铜均不溶于浓硫酸 | 常温下铁、铜与浓硫酸均不反应 |
| B | HCl与Na2CO3溶液反应生成CO2 | 用饱和Na2CO3溶液除去CO2中的少量HCl |
| C | Cl2使润湿的有色布条褪色,而干燥的布条不褪色 | 次氯酸的氧化性比氯气的强 |
| D | 稀、浓HNO3分别与铜反应,还原产物为NO和NO2 | 稀HNO3氧化性比浓HNO3强 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 现象或事实 | 解释 |
| A | 明矾用于净水 | 铝离子水解产生的胶体具有很强吸附杂质的作用 |
| B | SO2能使品红溶液褪色 | SO2具有漂白性 |
| C | “地沟油”禁止食用,但可以用来制肥皂 | “地沟油”主要成分为油脂属于酯类可以发生皂化反应 |
| D | 用氯水和淀粉溶液鉴别食盐是否加碘 | 目前加碘食盐中含碘元素物质为KI |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com