
【题目】共享单车开启低碳骑行新革命,不同单车制造的材料各异,关于材料说法正确的是
A. 轮胎橡胶有固定的熔点 B. 用铝合金代替钢制车架使车辆更轻
C. 使用的碳纤维属于金属材料 D. 制作车灯的有机玻璃是硅酸盐
科目:高中化学 来源: 题型:
【题目】已知NO2与N2O4可相互转化:2NO2(g)![]() N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是( )
N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是( )

A. 前10 min内,用v(NO2)表示的反应速率为0.04 mol·L-1·min-1
B. 反应进行到10 min时,体系放出的热量为9.68 kJ
C. a点正反应速率小于逆反应速率
D. 25 min时,正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。已知:298K时,四种物质的电离平衡常数(K)如下表。
HNO2 | NH3·H2O | H2CO3 | H2SO3 | |
K(mol·L-1)-2 | 5.1×10-4 | 1.8×10-5 | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10﹣2 Ka2=6.3×10﹣8 |
(1)下列不能说明HNO2是弱电解质的是_____。
A.常温下0.1 mol·L-1 NaNO2溶液的pH>7
B.用一定浓度HNO2溶液做导电实验,灯泡很暗
C.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
D.常温下,0.1mol·L-1 HNO2溶液的pH=2.3
(2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为_____(填“酸性”、“碱性”或“中性”),原因是___________________________。
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如右图所示,判断曲线I对应的溶液为_______(填化学式)。图中a、b、c三点对应溶液的导电能力由强到弱的顺序是
________(用a、b、c表示,下同);溶液中水的电离程度由强到弱的顺序是________。

(4)依据提供数据回答下列问题。
①求298K时,NaHSO3溶液中HSO3-水解平衡常数Kh =____;由此可判断HSO3-水解程度______电离程度(填“>”、“<”或“=”)。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为______。
(5)298K时,向含有2mol Na2CO3的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在生活及工业中运用广泛。
(1)氮氧化物排放是形成臭氧层空洞重要成因之一,氮氧化物破坏臭氧层原理为:i. NO+O3![]() NO2+O2 K1 ii. NO2+O
NO2+O2 K1 ii. NO2+O![]() NO+O2 K2
NO+O2 K2
则反应O3+O![]() 2O2 的平衡常数K=_____(用K1、K2表示)。NO在该反应过程中的作用是_______。
2O2 的平衡常数K=_____(用K1、K2表示)。NO在该反应过程中的作用是_______。
(2)N2H4是火箭发射的助燃剂。N2H4与氨气相似,溶于水生成弱碱N2H4·H2O,写出N2H4·H2O的电离方程式___________。
(3)已知t ℃时,KW=1×10-13,则t ℃_______25℃(填“>”、“<”或“=”)。在t ℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年国产大飞机C919试飞成功,飞机上使用了碳纤维复合材料。下列物质属于复合材料的是( )
A. 玻璃钢
B. 尼龙
C. 聚氯乙烯
D. 镁铝合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以N2和H2为反应物,盐酸酸化的NH4Cl溶液为电解质的原电池,工作原理如下图所示,下列说法不正确的是
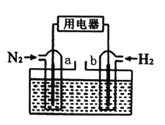
A. b电极为负极
B. 反应过程中,溶液中的Cl-向a电极移动
C. a电极的电极反应式为:N2+6e-+8H+=2NH4+
D. 电池反应为N2+3H2+2HCl=2NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z均为短周期主族元素,已知它们的原子序数的关系为X+Z=2Y,且Z的最高价氧化物对应的水化物是强酸。则下列有关说法正确的是
A. 若X是Na,则Z的最高价一定为偶数
B. 若X是O,则YX一定是离子化合物
C. 若Y是O,则非金属性Z>Y>X
D. 若Y是Na,则X、Z不可能是同一主族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20℃) Ag2SO4:0.796 g
(1)甲同学的实验如表:
序号 | 操作 | 现象 |
实验Ⅰ | 将2mL 1 molL-1 AgNO3溶液加入到1mL 1 molL-1 FeSO4溶液中 | 产生白色沉淀,随后又有黑色固体产生 |
取上层清液,滴加KSCN溶液 | 溶液变红 |
注:经检验黑色固体为Ag。
①白色沉淀的化学式是__________________。
②甲同学得出Ag+氧化了Fe2+的依据是_____________________________________。
(2)乙同学为探究Ag+和Fe2+的反应,进行实验II。
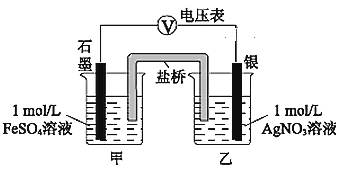
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
①盐桥中盛有饱和KNO3溶液,此盐桥中钾离子向________(填“甲”或“乙”)池移动;
②若该电池能维持稳定电流强度为1 A,工作600s,理论上Ag电极的质量会________(填“增重”或“溶解”) ________g(已知F=96500 C·mol-1,电量(C)=电流(A)×时间(s) )。
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
③a中甲烧杯里的电极反应式是______________。
④b中电压表指针逆向偏移后,银为_______(填“正”或“负”)极。
(3)由上述实验得出的结论为_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com